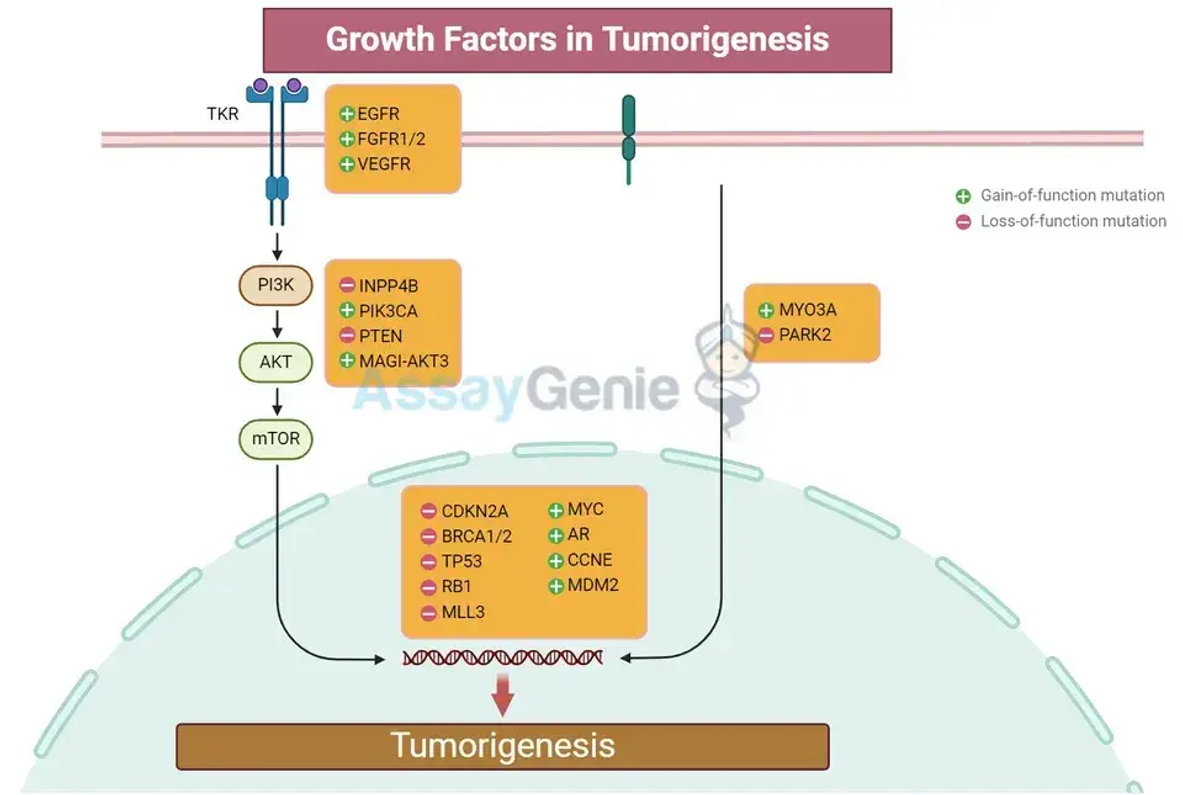
Wachstumsfaktoren können bei der Förderung der Tumorentstehung zusammenarbeiten
Einführung
Die Rolle von Wachstumsfaktoren bei der Zellregulation
Wichtige Wachstumsfaktoren bei der Tumorentstehung
Mechanismen der Zusammenarbeit zwischen Wachstumsfaktoren

Übersprechen zwischen Signalwegen
Modulation der Tumormikroumgebung
Induktion des epithelial-mesenchymalen Übergangs (EMT)

Neue Forschungsbereiche in der Wachstumsfaktorsignalisierung und Tumorentstehung
Ein weiterer vielversprechender Bereich ist die Untersuchung von Krebsstammzellen (CSCs) und ihrer Wechselwirkung mit Wachstumsfaktoren. CSCs sind eine kleine Untergruppe von Krebszellen mit der Fähigkeit, sich selbst zu erneuern und die Tumorentstehung voranzutreiben. Es ist bekannt, dass Wachstumsfaktoren wie EGF und FGF eine entscheidende Rolle bei der Aufrechterhaltung der CSC-Eigenschaften und der Förderung ihrer Therapieresistenz spielen. Die gezielte Ausrichtung auf Wachstumsfaktor-Signalwege in CSCs könnte neue Strategien zur Ausrottung von Tumoren und zur Verhinderung von Rückfällen liefern.
Mögliche therapeutische Ziele
Negative Regulatoren der Wachstumsfaktorsignalisierung: Die Verbesserung der Expression oder Aktivität negativer Regulatoren, wie z. B. Phosphatasen, die Tyrosinkinasen dephosphorylieren, stellt einen weiteren therapeutischen Weg dar. Die Wiederherstellung der Funktion dieser Regulatoren kann die Signalübertragung fehlerhafter Wachstumsfaktoren in Krebszellen dämpfen.
Tabelle 1: Kooperation von Wachstumsfaktoren bei der Tumorentstehung
Wachstumsfaktor | Rolle bei der Tumorentstehung | Mechanismus der Zusammenarbeit |
EGF | Zellproliferation und -differenzierung | Verstärkt onkogene Signale durch Wechselwirkung mit anderen Signalwegen |
FGF | Angiogenese und Zellüberleben | Arbeitet mit VEGF zusammen, um die Angiogenese zu verbessern |
VEGF | Angiogenese | Arbeitet mit FGF zusammen, um den Tumor mit Nährstoffen und Sauerstoff zu versorgen |
TGF-β | Tumorprogression und Immunsuppression | Induziert EMT und unterdrückt die Immunantwort, wodurch die Metastasierung erleichtert wird |
Implikationen für die Krebstherapie
Abschluss
Die Erforschung von Wachstumsfaktoren und ihren Signalwegen bei Krebs bietet ein reichhaltiges Umfeld für Forschung und therapeutische Entwicklung. Während wir die komplexen Mechanismen entschlüsseln, durch die Wachstumsfaktoren die Tumorentstehung und Therapieresistenz fördern, ergeben sich neue Möglichkeiten für gezielte Interventionen.
Durch die Konzentration auf die vielfältigen Rollen von Wachstumsfaktoren, von ihrer Regulierung durch miRNAs bis hin zu ihrer Beteiligung an der Aufrechterhaltung von Krebsstammzellpopulationen und der Auslösung von Therapieresistenzen, können Forscher innovative Strategien zur wirksameren Krebsbekämpfung entwickeln. Der Weg vom Verständnis zur wirksamen Bekämpfung der Wachstumsfaktorsignale bei Krebs ist mit Herausforderungen behaftet, birgt jedoch das Versprechen, präzisere und dauerhaftere Behandlungen für Krebspatienten zu ermöglichen.
Verweise
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024