VEGF-A-VEGFR-2-Signalisierung: Entschlüsselung des Bauplans der Angiogenese für therapeutische Erkenntnisse
Die Orchestrierung der Angiogenese, des Prozesses, bei dem sich aus bereits vorhandenen Blutgefäßen neue bilden, ist eine komplexe Symphonie, die von verschiedenen molekularen Akteuren reguliert wird. An der Spitze dieses komplizierten Tanzes steht der VEGF-A-VEGFR-2-Signalweg, ein zentraler Mechanismus, der das Wachstum und den Erhalt von Blutgefäßen vorantreibt. In dieser umfassenden Untersuchung befassen wir uns mit den molekularen Details dieses Signalwegs und beleuchten seine grundlegende Rolle bei der Angiogenese und seine Auswirkungen auf Gesundheit und Krankheit.
VEGF-A: Ein Hauptregulator der Angiogenese:
Der vaskuläre endotheliale Wachstumsfaktor A (VEGF-A) gilt als Leuchtturm in der VEGF-Familie der Wachstumsfaktoren. VEGF-A wird von verschiedenen Zelltypen, einschließlich Endothelzellen, Makrophagen und Tumorzellen, produziert und ist ein Glykoprotein, das auf Reize wie Hypoxie reagiert. Seine Rolle bei der Angiogenese ist beispiellos, da es an VEGF-Rezeptoren auf der Oberfläche von Endothelzellen bindet und eine Kaskade von Ereignissen auslöst, die in der Bildung neuer Blutgefäße gipfeln.
VEGFR-2: Der Meister der vaskulären Endothelreaktionen:
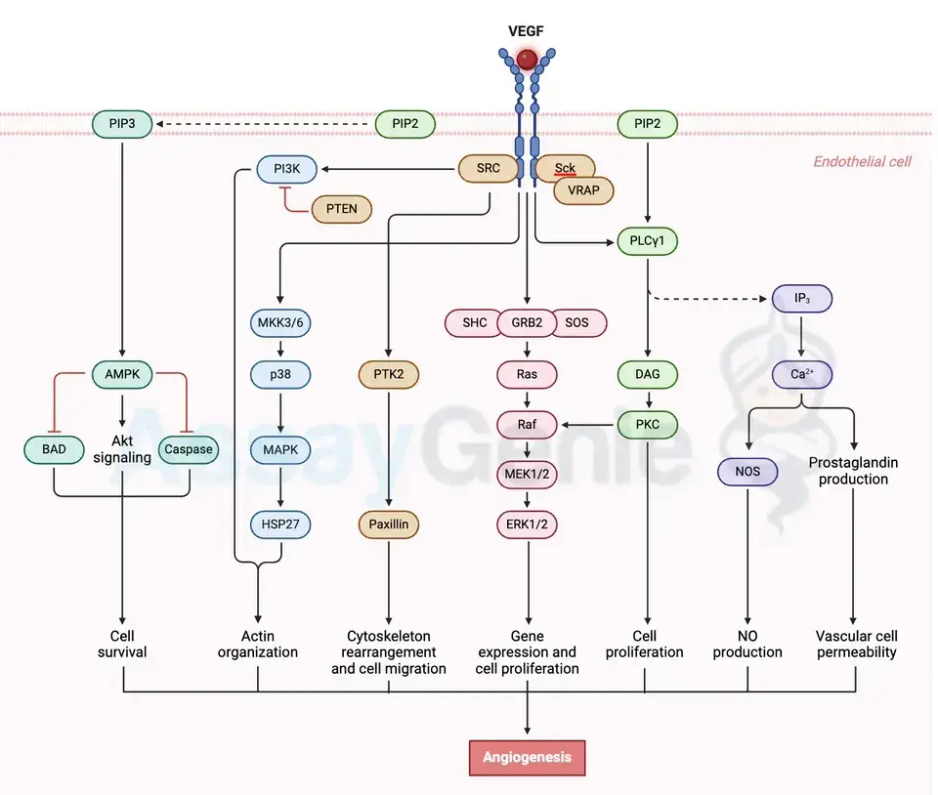
Im Mittelpunkt des VEGF-A-Signalwegs steht VEGFR-2, auch bekannt als KDR oder Flk-1. Als Rezeptor-Tyrosinkinase, die überwiegend auf Endothelzellen exprimiert wird, dient VEGFR-2 als primärer Mediator der angiogenen Wirkungen von VEGF-A. Die Bindung von VEGF-A an VEGFR-2 löst die Dimerisierung und Autophosphorylierung des Rezeptors aus und bereitet so die Voraussetzungen für die Aktivierung nachgeschalteter Signalwege.
Molekulares Ballett: VEGF-A-VEGFR-2-Signalweg:
Initiierung – Bindung von VEGF-A an VEGFR-2:
Die Choreografie beginnt mit der Bindung von VEGF-A an VEGFR-2, was eine Konformationsänderung im Rezeptor auslöst, die seine intrinsische Kinaseaktivität aktiviert.
Erhöhung – Autophosphorylierung von VEGFR-2:
Die Aktivierung von VEGFR-2 induziert die Autophosphorylierung spezifischer Tyrosinreste in der intrazellulären Domäne des Rezeptors und schafft so Andockstellen für eine Vielzahl von Signalproteinen.
Harmonie – Aktivierung nachgeschalteter Signalwege:
Phosphoryliertes VEGFR-2 rekrutiert und aktiviert Signalproteine wie PLCγ, PI3-Kinase und MAP-Kinasen und orchestriert zelluläre Reaktionen wie Proliferation, Migration und Überleben.
Expression – Endothelzellreaktionen:
Der aktivierte VEGF-A-VEGFR-2-Weg löst Veränderungen in der Genexpression aus, erhöht die Gefäßpermeabilität und fördert die Proliferation und Migration von Endothelzellen, was insgesamt zur Angiogenese beiträgt.
Höhepunkt – Angiogenese:
Der letzte Akt dieses molekularen Balletts ist die Angiogenese, bei der neue Blutgefäße sprießen und wachsen und so entscheidende physiologische Prozesse wie die Embryonalentwicklung, die Gewebereparatur und den Menstruationszyklus ermöglichen. Eine Fehlregulation dieses Signalwegs ist mit Erkrankungen wie Krebs und Gefäßerkrankungen verbunden.
Klinische Erkenntnisse und therapeutische Perspektiven:
Das Verständnis des VEGF-A-VEGFR-2-Signalwegs hat tiefgreifende klinische Auswirkungen. Die gezielte Ausrichtung auf diesen Signalweg ist zu einer therapeutischen Strategie geworden, insbesondere bei der Krebsbehandlung. Medikamente wie Bevacizumab, das VEGF-A hemmt, wurden entwickelt, um die Angiogenese in Tumoren zu stören, was die translationale Relevanz dieser Forschung unterstreicht.
Abschluss
Der VEGF-A-VEGFR-2-Signalweg entpuppt sich als faszinierende molekulare Erzählung, die komplexe molekulare Wechselwirkungen zur Regulierung der Angiogenese miteinander verknüpft. Diese Reise in die Tiefen der Gefäßbiologie bereichert nicht nur unser Verständnis grundlegender physiologischer Prozesse, sondern legt auch den Grundstein für innovative therapeutische Interventionen bei Erkrankungen, bei denen die Angiogenese eine zentrale Rolle spielt. Während wir weiterhin die Nuancen dieses Weges entschlüsseln, erschließen wir neue Möglichkeiten für den medizinischen Fortschritt und führen uns zu einem tieferen Verständnis von Gesundheit und Krankheit.
Referenzen:
1. Ferrara, N. & Adamis, A. P. (2016). Zehn Jahre antivaskuläre endotheliale Wachstumsfaktortherapie. Nature Reviews Drug Discovery, 15(6), 385-403.
2. Olsson, A. K., Dimberg, A., Kreuger, J. & Claesson-Welsh, L. (2006). VEGF-Rezeptor-Signalisierung – bei der Steuerung der Gefäßfunktion. Nature Reviews Molecular Cell Biology, 7(5), 359-371.
3. Shibuya, M. (2011). Vaskulärer endothelialer Wachstumsfaktor (VEGF) und sein Rezeptor (VEGFR) signalisieren bei der Angiogenese: Ein entscheidendes Ziel für anti- und proangiogene Therapien. Genes & Cancer, 2(12), 1097-1105.
4. Carmeliet, P. & Jain, R. K. (2011). Molekulare Mechanismen und klinische Anwendungen der Angiogenese. Natur, 473(7347), 298-307.
5. Ferrara, N., Gerber, H. P. & LeCouter, J. (2003). Die Biologie von VEGF und seinen Rezeptoren. Naturmedizin, 9(6), 669-676.
6. Cross, M. J. & Claesson-Welsh, L. (2001). FGF- und VEGF-Funktion bei der Angiogenese: Signalwege, biologische Reaktionen und therapeutische Hemmung. Trends in Pharmacological Sciences, 22(4), 201-207.
7. Koch, S., Tugues, S., Li, X., Gualandi, L. & Claesson-Welsh, L. (2011). Signaltransduktion durch vaskuläre endotheliale Wachstumsfaktorrezeptoren. Biochemical Journal, 437(2), 169-183.
22nd Aug 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024