Umfassende Analyse der Antikörperstruktur und -funktion
Antikörper oder Immunglobuline sind wichtige Bestandteile des Immunsystems und steuern die Identifizierung und Neutralisierung von Krankheitserregern wie Viren und Bakterien. Ziel dieses ausführlichen Artikels ist es, ein umfassendes Verständnis der anspruchsvollen Architektur und der vielfältigen Rollen von Antikörpern zu vermitteln und sich mit ihrer molekularen Zusammensetzung, den Mechanismen hinter ihrer Diversität und Spezifität sowie ihren integralen Funktionen innerhalb der Immunantwort zu befassen.
Grundlegende Architektur von Antikörpern
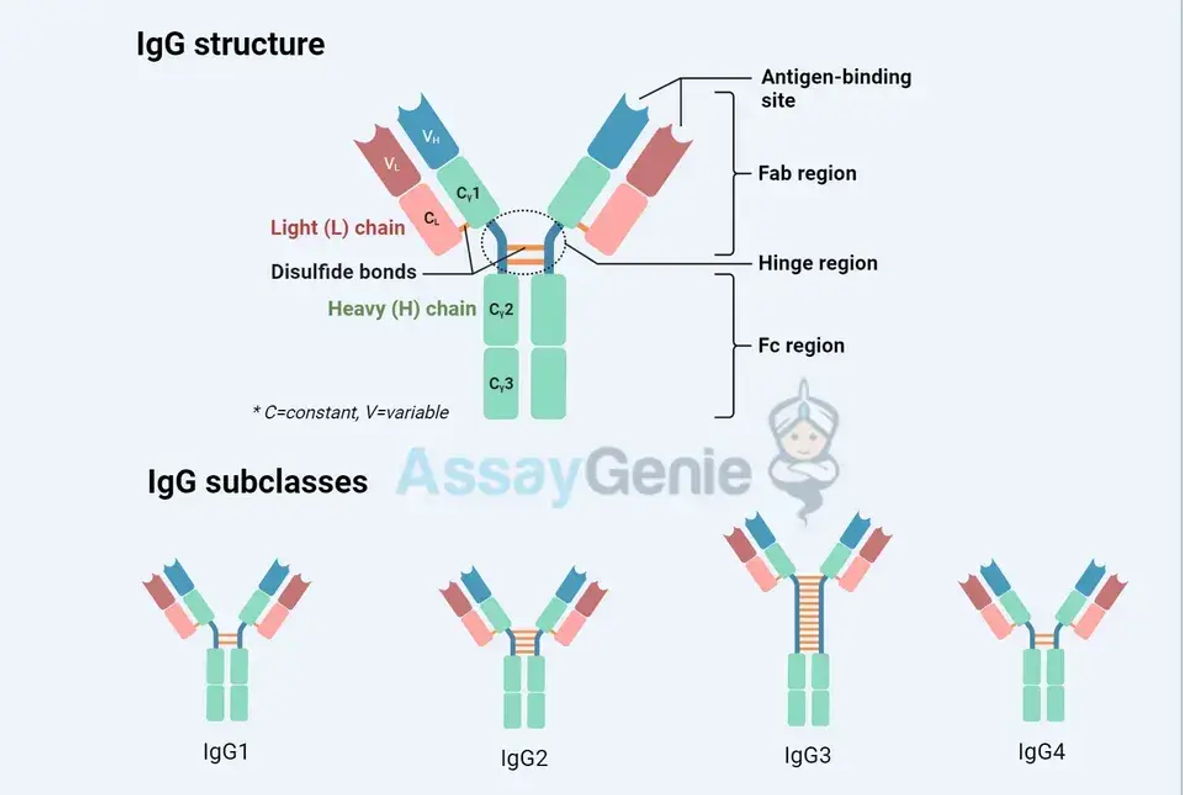
Antikörper sind Y-förmige Moleküle, die aus vier Polypeptidketten bestehen: zwei identischen schweren Ketten und zwei identischen leichten Ketten. Diese Ketten sind durch Disulfidbindungen und nichtkovalente Wechselwirkungen miteinander verbunden und bilden eine Struktur, die sowohl stabil als auch flexibel ist und eine effiziente Antigenerkennung und -bindung ermöglicht.
Strukturbestandteile von Antikörpern
Schwere und leichte Ketten: Das strukturelle Rückgrat
Schwere Ketten: Definieren den Isotyp des Antikörpers und sind entscheidend für die Bestimmung seiner Effektorfunktion. Es gibt fünf Haupttypen schwerer Ketten, die den Antikörper-Isotypen entsprechen (IgM, IgD, IgG, IgE, IgA).
Leichte Ketten: Es gibt sie in zwei Varianten, Kappa (κ) und Lambda (λ), und sie sind für die Bildung der Antigenbindungsstelle neben den schweren Ketten unerlässlich.

Variable und konstante Regionen: Die Basis für Vielfalt und Funktion
1. Ariable (Fab)-Region: Diese Region befindet sich an den Spitzen der Y-förmigen Struktur und ist für die Antigenbindung verantwortlich. Die Variabilität der Aminosäuresequenzen in dieser Region ermöglicht es Antikörpern, eine Vielzahl von Antigenen zu erkennen.
2. Konstante (Fc) Region: Diese Region bestimmt den Isotyp des Antikörpers und vermittelt verschiedene Effektorfunktionen durch Interaktion mit verschiedenen Komponenten des Immunsystems.
Isotypenwechsel: Anpassung der Immunantwort
Isotype switching is a mechanism that allows an antibody to change its constant region, thereby altering its effector functions without affecting its antigen specificity. This process enables the immune system to tailor its response to different stages of infection and various types of pathogens.
Tabelle 1: Antikörper-Isotypen und ihre Funktionen
Isotyp | Funktion | Standort |
IgG | Systemische Immunität, Neutralisierung, Opsonisierung | Blut, extrazelluläre Flüssigkeit |
IgA | Schleimhautimmunität, Neutralisierung | Schleimhautbereiche |
IgM | Frühe Immunantwort, Agglutination | B-Zelloberfläche, Blut |
IgE | Allergie, Abwehr von Parasiten | An Mastzellen und Basophile gebunden |
IgD | B-Zell-Rezeptor | B-Zelloberfläche |
Mechanismen hinter der Antikörpervielfalt
Das menschliche Immunsystem kann eine immense Vielfalt an Antikörpern produzieren, von denen jeder das Potenzial hat, ein bestimmtes Antigen zu erkennen. Diese Vielfalt wird durch mehrere genetische und molekulare Mechanismen erzeugt:
V(D)J-Rekombination und somatische Hypermutation: Die Motoren der Vielfalt
V(D)J-Rekombination: Der genetische Shuffle
Die V(D)J-Rekombination ist der primäre Mechanismus der Diversität in den variablen Regionen des Antikörpers, wobei verschiedene Gensegmente V (Variable), D (Diversität) und J (Verbindung) zufällig zusammengesetzt werden. Diese Rekombination findet sowohl bei B- als auch bei T-Zellen am Locus der schweren Kette und bei B-Zellen nur am Locus der leichten Kette statt und legt damit den Grundstein für die Antigenspezifität.
Somatische Hypermutation und Affinitätsreifung
Nach der anfänglichen Antigen-Exposition zielt die somatische Hypermutation auf die variablen Regionen des Antikörper-Gens ab und führt zu Mutationen, die die Affinität für das Antigen erhöhen oder verringern können. B-Zellen mit Antikörpern mit höherer Affinität empfangen Überlebens- und Proliferationssignale, was im Laufe der Zeit zu einer Affinitätsreifung führt.
Tabelle 2: Mechanismen der Antikörperdiversität
Mechanismus | Beschreibung |
V(D)J-Rekombination | Zufällige Anordnung von V-, D- und J-Gensegmenten. |
Somatische Hypermutation | Mutationen in Genen der variablen Region erhöhen die Affinität. |
Isotypwechsel | Änderungen in der konstanten Region verändern die Effektorfunktionen. |
Komplementaritätsbestimmende Regionen (CDRs): Schlüssel zur Antigenerkennung
Die Antigenbindungsstelle eines Antikörpers wird durch die variablen Domänen der schweren und leichten Ketten gebildet, wobei drei komplementaritätsbestimmende Regionen (CDRs) in jeder Domäne eine entscheidende Rolle bei der Antigenerkennung spielen. CDR3 ist aufgrund seiner hohen Variabilität von besonderer Bedeutung und trägt direkt zur Spezifität der Antigenbindung bei.

Die vielfältigen Rollen von Antikörpern bei der Immunantwort
Antikörper können viel mehr als nur an Antigene binden. Sie lösen eine Kaskade von Immunreaktionen aus, die dabei helfen, Krankheitserreger zu neutralisieren und zu eliminieren.
Durch die konstante Region vermittelte Effektorfunktionen
Die Fc-Region von Antikörpern interagiert mit Fc-Rezeptoren auf der Oberfläche von Immunzellen und löst verschiedene Effektorfunktionen aus:
Neutralisierung: Blockierung der Infektion von Wirtszellen durch Krankheitserreger.
Opsonisierung: Markierung von Krankheitserregern zur Zerstörung durch Phagozyten.
Komplementaktivierung: Initiierung der Komplementkaskade, die zur Lyse von Krankheitserregern führt.
Antikörperabhängige zelluläre Zytotoxizität (ADCC): Rekrutierung natürlicher Killerzellen (NK), um mit Antikörpern beschichtete Ziele zu zerstören.
Tabelle 3: Antikörper-Effektorfunktionen
Funktion | Beschreibung |
Neutralisation | Blockierung von Krankheitserregern oder Toxinen. |
Opsonisierung | Erleichterung der Phagozytose. |
Komplementaktivierung | Auslösen der Pathogenlyse. |
ADCC | Zerstörung von mit Antikörpern beschichteten Zielen. |
Erweitertes Verständnis der Antikörperfunktion
Antikörper wirken nicht isoliert; Ihre Wechselwirkungen mit anderen Komponenten des Immunsystems verstärken ihre Wirksamkeit. Die Interaktion der Fc-Region mit Fc-Rezeptoren auf Immunzellen löst eine Kaskade von Reaktionen aus, darunter Phagozytose, antikörperabhängige zelluläre Zytotoxizität (ADCC) und Komplementaktivierung, was die Rolle des Antikörpers als Brücke zwischen angeborener und adaptiver Immunität verdeutlicht.
Abschluss
Zusammenfassend lässt sich sagen, dass Antikörper nicht nur zentrale Akteure bei der Abwehr von Krankheitserregern durch das Immunsystem sind, sondern auch Beispiele für biologische Vielfalt und Spezifität. Durch eine Kombination aus genetischen Mechanismen und funktioneller Anpassungsfähigkeit stellen sie einen dynamischen und vielseitigen Abwehrmechanismus bereit, der auf eine sich ständig ändernde Reihe von Infektionserregern reagieren kann. Diese umfassende Analyse unterstreicht die Komplexität der Immunantwort und die entscheidende Rolle, die Antikörper dabei spielen.
Verweise
- Murphy, K., Travers, P., Walport, M. & Janeway, C. (2017). Janeways Immunbiologie (9. Aufl.). Girlandenwissenschaft. Ein grundlegendes Lehrbuch, das eine detaillierte Abdeckung der immunologischen Prinzipien und Mechanismen bietet, einschließlich der Struktur und Funktion von Antikörpern.
- Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K. & Walter, P. (2014). Molekularbiologie der Zelle (6. Aufl.). Girlandenwissenschaft. Bietet einen umfassenden Überblick über zelluläre Mechanismen, einschließlich der molekularen Grundlagen des Immunsystems.
- Tonegawa, S. (1983). Somatische Erzeugung von Antikörpervielfalt. Natur, 302(5909), 575-581.
- Rajewsky, K. (1996). Klonale Selektion und Lernen im Antikörpersystem. Natur, 381(6585), 751-758.
- Nimmerjahn, F. & Ravetch, JV (2008). Fcγ-Rezeptoren als Regulatoren von Immunantworten. Nature Reviews Immunology, 8(1), 34-47.
- Schmitz, R., Young, R. M., Ceribelli, M., Jhavar, S., Xiao, W., Zhang, M., Wright, G., Shaffer, A. L., Hodson, D. J., Buras, E., Liu, X ., Powell, J., Yang, Y., Xu, W., Zhao, H., Kohlhammer, H., Rosenwald, A., Kluin, P., Muller-Hermelink, H. K., Ott, G., Gascoyne, R. D., Connors, J. M., Rimsza, L. M., Campo, E., Jaffe, E. S., Delabie, J., Smeland, E. B., Ogwang, M. D., Reynolds, S. J., Fisher, R. I., Braziel, R. M., Kridel, R., Chan , W. C., Weisenburger, D. D. & Staudt, L. M. (2012). Pathogenese des Burkitt-Lymphoms und therapeutische Ziele aus struktureller und funktioneller Genomik. Natur, 490(7418), 116-120.
- Abbas, A. K., Lichtman, A. H. & Pillai, S. (2020). Zelluläre und molekulare Immunologie (10. Aufl.). Sonst.
- Hozumi, N. & Tonegawa, S. (1976). Hinweise auf eine somatische Neuanordnung von Immunglobulin-Genen, die für variable und konstante Regionen kodieren. Proceedings of the National Academy of Sciences, 73(10), 3628-3632.
29th Jun 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024