Ubiquitin und seine Rolle bei der Zellregulation: Ein umfassender Überblick über Modifikatoren und Signalwege
Ubiquitin ist ein kleines, hochkonserviertes Protein, das in eukaryotischen Zellen vorkommt und eine entscheidende Rolle bei der Regulierung verschiedener zellulärer Prozesse spielt. Der Prozess der Ubiquitinierung beinhaltet die kovalente Bindung von Ubiquitin-Molekülen an Zielproteine und markiert diese für den Abbau, die Lokalisierung oder die Signalübertragung. Diese posttranslationale Modifikation ist ein dynamischer und streng regulierter Prozess, der zahlreiche zelluläre Signalwege beeinflusst. In diesem Artikel werden wir die Struktur und Funktion von Ubiquitin, seinen zugehörigen Modifikatoren und den komplizierten Signalwegen untersuchen, die an der Ubiquitin-vermittelten zellulären Regulation beteiligt sind.
Struktur und Funktion von Ubiquitin:
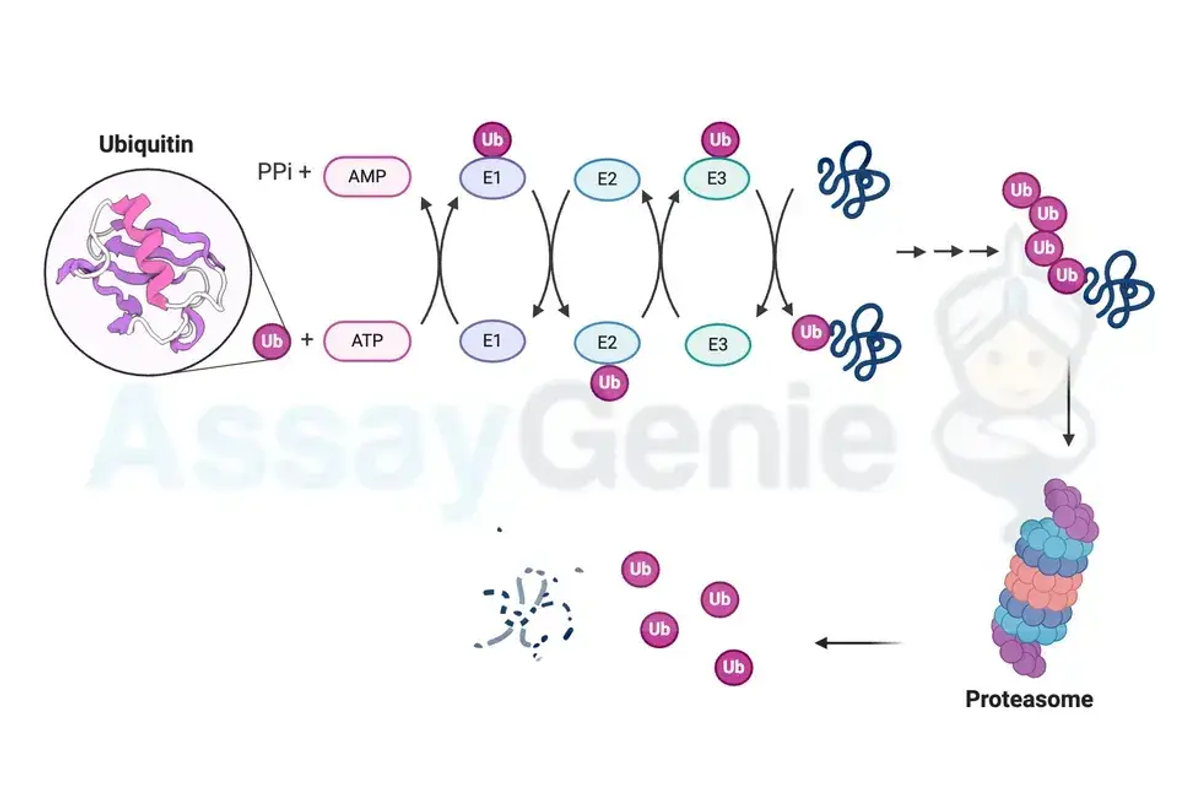
Ubiquitin, ein Protein mit 76 Aminosäuren, zeichnet sich durch eine hochkonservierte kugelförmige Faltung aus. Seine Struktur besteht aus einer β-Greiffalte und einem C-terminalen Schwanz, die für seine Funktion entscheidend sind. Die kovalente Bindung von Ubiquitin an Substratproteine erfolgt über seinen C-terminalen Glycinrest. Dieser Ubiquitinierungsprozess wird durch eine Kaskade von Enzymen gesteuert, die als E1 (Ubiquitin-aktivierendes Enzym), E2 (Ubiquitin-konjugierendes Enzym) und E3 (Ubiquitin-Ligase) bekannt sind. Während E1 Ubiquitin ATP-abhängig aktiviert, überträgt E2 das aktivierte Ubiquitin auf das Zielprotein und E3 erleichtert die Übertragung und sorgt für Spezifität.

Structure of Ubiquitin
Ubiquitin-Modifikation und Varianten:
Ubiquitin selbst kann verschiedene Modifikationen durchlaufen, die zur Bildung von Ubiquitinketten mit unterschiedlichen Strukturen und Funktionen führen. Die bekannteste Modifikation ist die Polyubiquitinierung, bei der Ubiquitinmoleküle über spezifische Lysinreste miteinander verbunden werden. Lysin-48-verknüpfte Polyubiquitinketten zielen auf Proteine ab, die durch das Proteasom, einen großen Proteasekomplex, abgebaut werden. Im Gegensatz dazu spielen Lysin-63-verknüpfte Ketten eine Rolle bei der DNA-Reparatur, Endozytose und anderen nicht-proteasomalen Prozessen.
Darüber hinaus kann Ubiquitin durch Monoubiquitinierung modifiziert werden, bei der ein einzelnes Ubiquitinmolekül an ein Substrat gebunden wird. Monoubiquitinierung reguliert häufig zelluläre Prozesse wie DNA-Reparatur, Endozytose und Transkription. Darüber hinaus hat die Entdeckung linearer Ubiquitin-Ketten, bei denen Ubiquitin-Moleküle Kopf-an-Schwanz miteinander verbunden sind, neue Wege für die Erforschung ihrer Rolle bei Immunreaktionen und Entzündungen eröffnet.
Ubiquitin-Ligasen und E3-Ubiquitin-Ligasen:
Die Spezifität der Ubiquitinierung wird maßgeblich durch E3-Ubiquitin-Ligasen bestimmt, die die Übertragung von Ubiquitin vom E2-Enzym auf das Zielprotein vermitteln. Das menschliche Genom kodiert Hunderte von E3-Ligasen, jede mit spezifischen Fähigkeiten zur Substraterkennung und Ubiquitinübertragung. Bemerkenswerte Beispiele sind die Skp1-Cullin-F-Box (SCF)-Komplexe, wirklich interessante neue Genligasen (RING) und homologe E6AP Carboxylterminusligasen (HECT) zu .
Die SCF-Komplexe, bestehend aus Skp1, Cullin, F-Box-Protein und einem zugehörigen RING-Fingerprotein, tragen zur Spezifität der Substraterkennung bei. RING-Ligasen hingegen ermöglichen die direkte Übertragung von Ubiquitin vom E2-Enzym auf das Substrat. HECT-Ligasen wie E6AP (E6-assoziiertes Protein) bilden mit Ubiquitin ein Thioester-Zwischenprodukt, bevor sie es auf das Substrat übertragen.
Ubiquitin-vermittelte Wege:
Ubiquitin-Proteasom-System (UPS)
Ubiquitinierung ist an einer Vielzahl zellulärer Signalwege beteiligt und ihre Fehlregulation wird mit verschiedenen Krankheiten in Verbindung gebracht, darunter Krebs, neurodegenerative Erkrankungen und Immunstörungen. Ein prominenter durch Ubiquitinierung regulierter Weg ist das Ubiquitin-Proteasom-System (UPS), das für den gezielten Abbau von Proteinen verantwortlich ist. UPS spielt eine entscheidende Rolle bei der Aufrechterhaltung der zellulären Homöostase, indem es fehlgefaltete oder beschädigte Proteine beseitigt.
Autophagie-Weg
Ein weiterer wesentlicher Signalweg, der durch Ubiquitin beeinflusst wird, ist die Autophagie, ein zellulärer Prozess, der für den Abbau und das Recycling von Zellbestandteilen verantwortlich ist. Die Ubiquitinierung dient als Signal für die selektive Autophagie und leitet bestimmte Ladungen zum Abbau zu den Autophagosomen.
Die Rolle von Ubiquitin reicht über den Proteinabbau hinaus bis hin zur Regulierung von DNA-Reparaturmechanismen. Die Ubiquitinierung von DNA-Reparaturproteinen beeinflusst die Effizienz von Reparaturprozessen, sorgt für genomische Stabilität und verhindert die Anhäufung von Mutationen.
Darüber hinaus beruht die Immunantwort auf Ubiquitin-vermittelten Signalen. Lineare Ubiquitinketten sind beispielsweise entscheidend für die Aktivierung des Kernfaktors Kappa B (NF-κB), eines Transkriptionsfaktors, der an Immun- und Entzündungsreaktionen beteiligt ist.
Abschluss:
Ubiquitin, seine zugehörigen Modifikatoren und die komplizierten Wege, die es reguliert, unterstreichen die Komplexität zellulärer Prozesse. Vom Proteinabbau über die DNA-Reparatur bis hin zu Immunantworten dient die Ubiquitinierung als entscheidende posttranslationale Modifikation, die die zelluläre Homöostase aufrechterhält. Das Verständnis der molekularen Mechanismen, die an Ubiquitin-vermittelten Signalwegen beteiligt sind, ist nicht nur für die Aufklärung grundlegender Aspekte der Zellbiologie von entscheidender Bedeutung, sondern bietet auch großes Potenzial für die Entwicklung therapeutischer Interventionen bei Krankheiten, die mit einer Ubiquitin-Dysregulation einhergehen.
Referenzen
1. Hershko A, Ciechanover A. Das Ubiquitin-System. Annu Rev Biochem. 1998;67:425-479.
2. Komander D, Rape M. Der Ubiquitin-Code. Annu Rev Biochem. 2012;81:203-229.
3. Pickart CM, Eddins MJ. Ubiquitin: Strukturen, Funktionen, Mechanismen. Biochim Biophys Acta. 2004;1695(1-3):55-72.
4. Komander D, Clague MJ, Urbé S. Brechen der Ketten: Struktur und Funktion der Deubiquitinasen. Nat Rev Mol Cell Biol. 2009;10(8):550-563.
5. Popovic D, Vucic D, Dikic I. Ubiquitinierung in der Pathogenese und Behandlung von Krankheiten. Nat Med. 2014;20(11):1242-1253.
16th Aug 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024