Toll-like-Rezeptor-Signalwege: Ein Schlüssel zur angeborenen Immunität
In der komplexen Landschaft des Immunsystems spielen Toll-like-Rezeptoren (TLRs) eine grundlegende Rolle in der ersten Verteidigungslinie gegen Krankheitserreger. Diese Rezeptoren, wesentliche Bestandteile der angeborenen Immunantwort, sind in der Lage, spezifische mikrobielle Muster zu erkennen und Signalwege zu initiieren, die zur Aktivierung von Immunantworten führen. Dieser Artikel befasst sich eingehend mit den Signalwegen der Toll-like-Rezeptoren und unterstreicht deren Bedeutung für die Immunologie und mögliche therapeutische Anwendungen.
Toll-like-Rezeptoren verstehen
Oll-like-Rezeptoren sind eine Klasse von Proteinen, die eine entscheidende Rolle im Immunsystem spielen, indem sie mikrobielle Infektionen erkennen und die Immunantwort aktivieren. Diese Rezeptoren zeichnen sich durch ihre Fähigkeit aus, Pathogen-assoziierte molekulare Muster (PAMPs) durch ihre extrazellulären Leucin-reichen Wiederholungsmotive zu erkennen und die Signaltransduktion durch ihre zytoplasmatische Toll/Interleukin-1-Rezeptor (TIR)-Domäne zu initiieren.
Die Signalwege
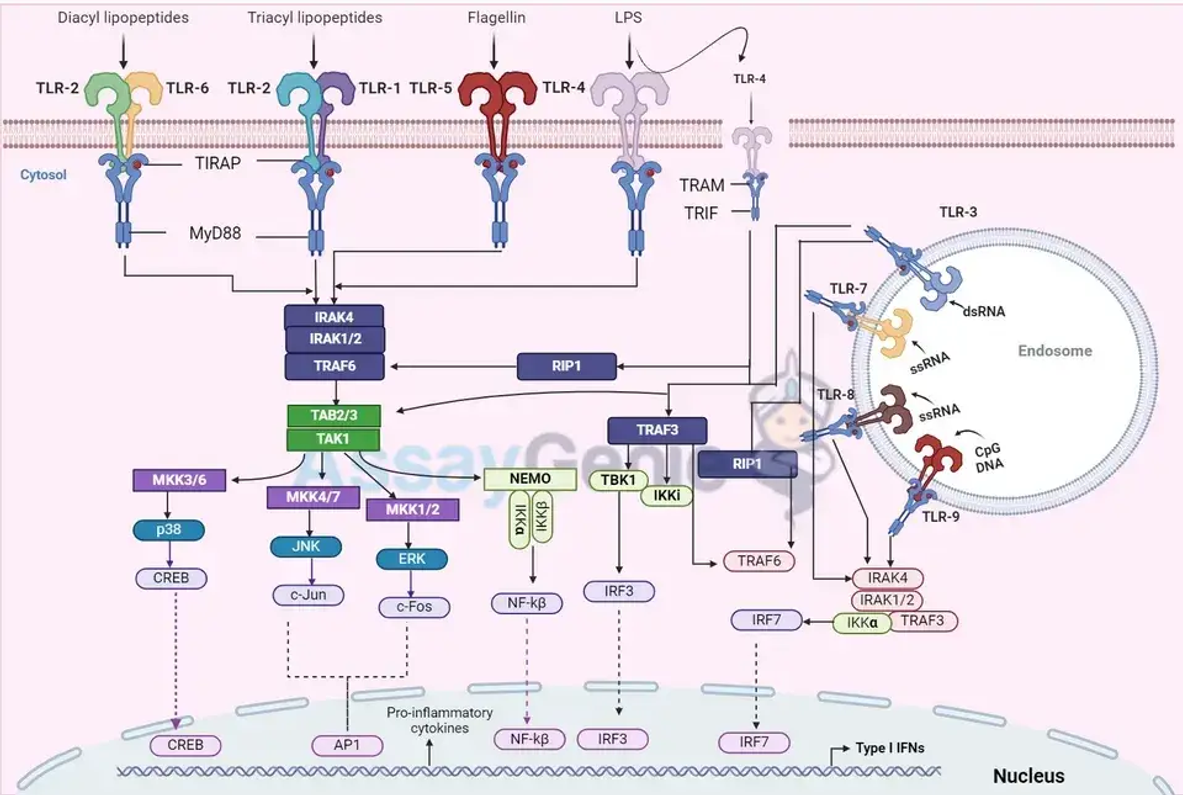
Die TLR-Aktivierung löst zwei Hauptsignalwege aus: den MyD88-abhängigen und den TRIF-abhängigen Weg, die zur Produktion von Zytokinen bzw. Typ-I-Interferonen führen. Diese Signalwege spielen eine entscheidende Rolle bei der Auslösung und Modulation der Immunantwort auf Krankheitserreger.
Der MyD88-abhängige Pfad
Dieser von den meisten TLRs initiierte Weg umfasst das Adapterprotein MyD88 und führt zur Aktivierung von NF-κB- und MAP-Kinasen, was zur Produktion entzündungsfördernder Zytokine führt. Diese Reaktion ist entscheidend für die unmittelbare Abwehr von Infektionen.
Der TRIF-abhängige Pfad
Diversität und Spezifität von TLR-Liganden
TLR4 ist beispielsweise vor allem für seine Rolle beim Nachweis von Lipopolysaccharid (LPS) bekannt, einem Bestandteil der Außenmembran gramnegativer Bakterien. Dieser Nachweis ist entscheidend für den Aufbau einer wirksamen Abwehr gegen diese Bakterien, unterstreicht aber auch die Bedeutung der Regulierung der TLR4-Signalübertragung, um übermäßige Entzündungen zu verhindern, die zu Sepsis führen können. Andererseits erkennt TLR3 doppelsträngige RNA (dsRNA), ein molekulares Muster, das mit Virusinfektionen in Zusammenhang steht und eine wichtige Rolle bei der antiviralen Immunität spielt.
Übersprechen und Regulierung der TLR-Signalisierung
Die durch die TLR-Aktivierung initiierten Signalwege funktionieren nicht isoliert; Es gibt erhebliche Wechselwirkungen zwischen den MyD88-abhängigen und TRIF-abhängigen Signalwegen sowie Wechselwirkungen mit anderen Signalwegen innerhalb der Zelle. Dieses Übersprechen ist für die Koordinierung einer umfassenden Immunantwort unerlässlich, erfordert aber auch eine präzise Regulierung, um eine fehlerhafte Aktivierung zu vermeiden, die zu Autoimmunerkrankungen führen kann.
Therapeutische Ziele innerhalb der TLR-Pfade
Aufgrund ihrer zentralen Rolle bei Immunität und Entzündung stellen TLRs und ihre Signalwege attraktive Ziele für therapeutische Interventionen dar. Medikamente, die die TLR-Signalübertragung modulieren können, haben das Potenzial, Immunreaktionen gegen Infektionen und Krebs zu verstärken oder unangemessene Entzündungen bei Autoimmunerkrankungen und chronischen Entzündungszuständen zu unterdrücken.
Beispielsweise werden TLR-Agonisten als Adjuvantien in Impfstoffen untersucht, um die Immunantwort auf das Impfantigen zu verstärken. Umgekehrt werden TLR-Antagonisten als potenzielle Behandlungsmöglichkeiten für Autoimmunerkrankungen untersucht, bei denen eine Dämpfung der Immunantwort die Krankheitssymptome lindern könnte.
Abschluss
Das erweiterte Verständnis der Signalwege von Toll-like-Rezeptoren unterstreicht die Ausgereiftheit des angeborenen Immunsystems. Es zeigt das Gleichgewicht zwischen der Aktivierung notwendiger Abwehrkräfte gegen Krankheitserreger und der Verhinderung übermäßiger Entzündungen, die zu Krankheiten führen können. Die laufende Forschung zu TLRs und ihren Signalwegen verspricht neue Therapiestrategien, die die angeborene Immunantwort nutzen oder modulieren, um eine Vielzahl von Krankheiten zu verhindern oder zu behandeln.
Verweise
1. Akira, S., Uematsu, S. & Takeuchi, O. (2006). Erkennung von Krankheitserregern und angeborene Immunität. Zelle, 124(4), 783-801.
2. Kawai, T. & Akira, S. (2010). Die Rolle von Mustererkennungsrezeptoren bei der angeborenen Immunität: Update zu Toll-like-Rezeptoren. Nature Immunology, 11(5), 373-384.
3. O'Neill, L.A.J., Golenbock, D. & Bowie, A.G. (2013). Die Geschichte der Toll-like-Rezeptoren – eine Neudefinition der angeborenen Immunität. Nature Reviews Immunology, 13(6), 453-460.
4. Takeda, K. & Akira, S. (2005). Toll-like-Rezeptoren in der angeborenen Immunität. International Immunology, 17(1), 1-14.
5. Barton, G. M. & Kagan, J. C. (2009). Eine zellbiologische Sicht auf die Funktion von Toll-like-Rezeptoren: Regulierung durch Kompartimentierung. Nature Reviews Immunology, 9(8), 535-542.
6. Fitzgerald, K.A., et al. (2003). Die LPS-TLR4-Signalisierung an IRF-3/7 und NF-κB umfasst die Mautadapter TRAM und TRIF. Journal of Experimental Medicine, 198(7), 1043-1055.
7. Yamamoto, M., et al. (2003). Rolle des Adapter-TRIF im MyD88-unabhängigen Toll-like-Rezeptor-Signalweg. Wissenschaft, 301(5633), 640-643.
8. Medzhitov, R. & Janeway, C.A. Jr. (1997). Angeborene Immunität: die Vorzüge eines nichtklonalen Erkennungssystems. Zelle, 91(3), 295-298.
9. Vance, R.E., Isberg, R.R. & Portnoy, D.A. (2009). Pathogenesemuster: Unterscheidung pathogener und nichtpathogener Mikroben durch das angeborene Immunsystem. Cell Host & Microbe, 6(1), 10-21.
3rd Aug 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024