T-Zell-Müdigkeit verstehen: Auswirkungen auf die Immunfunktion und therapeutische Interventionen
Mechanismen der T-Zell-Ermüdung:
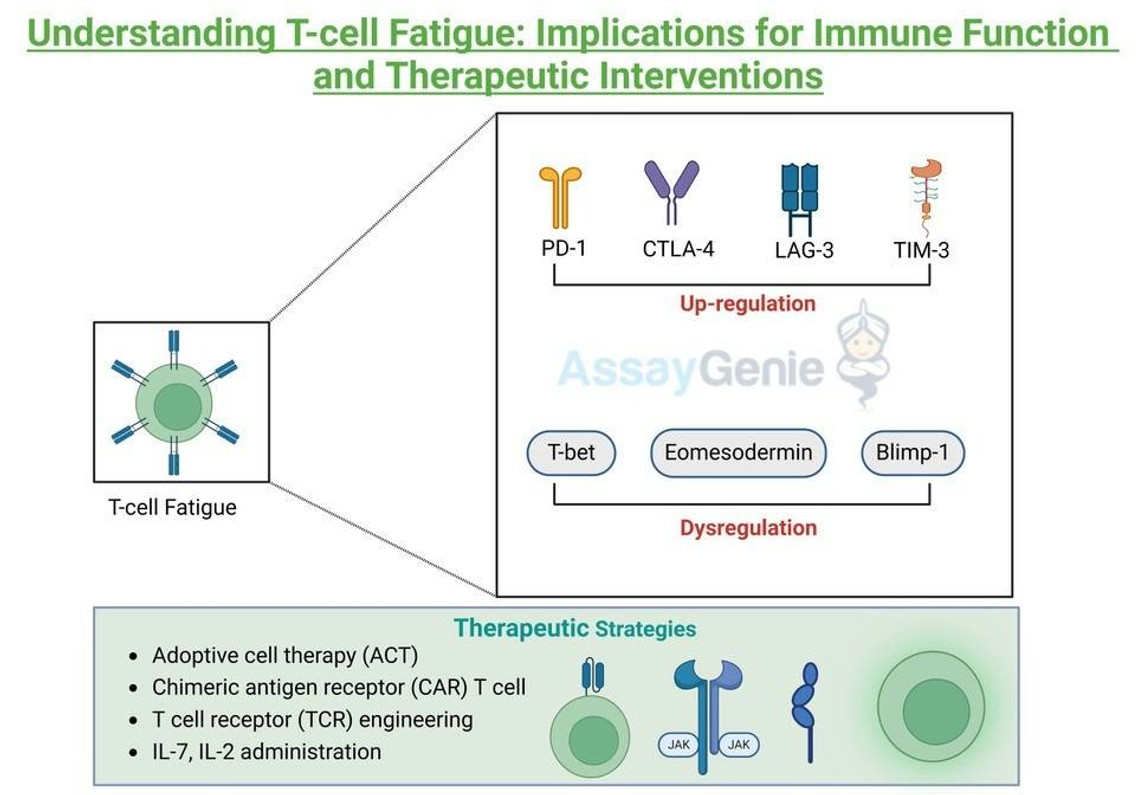
Die Interaktion dieser Rezeptoren mit ihren Liganden, die häufig auf Zielzellen oder Antigen-präsentierenden Zellen überexprimiert werden, initiiert inhibitorische Signalkaskaden und dämpft die T-Zell-Aktivierung und Effektorfunktionen. Darüber hinaus zeigt die Transkriptionsprofilierung erschöpfter T-Zellen eine gestörte Expression wichtiger Transkriptionsfaktoren wie T-bet, Eomesodermin (Eomes) und Blimp-1, die Effektor- und Erschöpfungsprogramme orchestrieren. Darüber hinaus trägt eine metabolische Umprogrammierung, die durch eine beeinträchtigte Mitochondrienfunktion und Glykolyse gekennzeichnet ist, zur Funktionsstörung der T-Zellen bei Erschöpfung bei.

Schematische Darstellung des Mechanismus der T-Zellen-Ermüdung
Folgen der T-Zell-Müdigkeit:
Therapeutische Strategien bei T-Zell-Müdigkeit:
Darüber hinaus bieten Ansätze der adoptiven Zelltherapie (ACT), einschließlich chimärer Antigenrezeptor (CAR)-T-Zellen und T-Zellrezeptor (TCR)-Engineering, personalisierte Strategien zur Verstärkung der T-Zell-Reaktionen gegen Krebs und chronische Infektionen. Darüber hinaus können zytokinbasierte Therapien wie die Verabreichung von Interleukin-2 (IL-2) oder Interleukin-7 (IL-7) die T-Zell-Proliferation und Effektorfunktionen verbessern und so möglicherweise erschöpfungsbedingte Defekte überwinden.
Abschluss:
Verweise:
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024