So wählen Sie einen Sekundärantikörper aus
Die Auswahl eines sekundären Antikörpers ist ein entscheidender Schritt im experimentellen Design verschiedener Immundetektionsmethoden, einschließlich Western Blot, ELISA, Immunhistochemie (IHC) und Immunfluoreszenz (IF). Sekundärantikörper dienen als entscheidende Werkzeuge zur Verstärkung der Signalerkennung und ermöglichen es Forschern, spezifische Antigene mit hoher Empfindlichkeit und Spezifität zu beobachten. Dieser Artikel bietet einen umfassenden Leitfaden zur Auswahl des richtigen Sekundärantikörpers für Ihre Forschung, um den Erfolg Ihrer Immundetektionstests sicherzustellen.
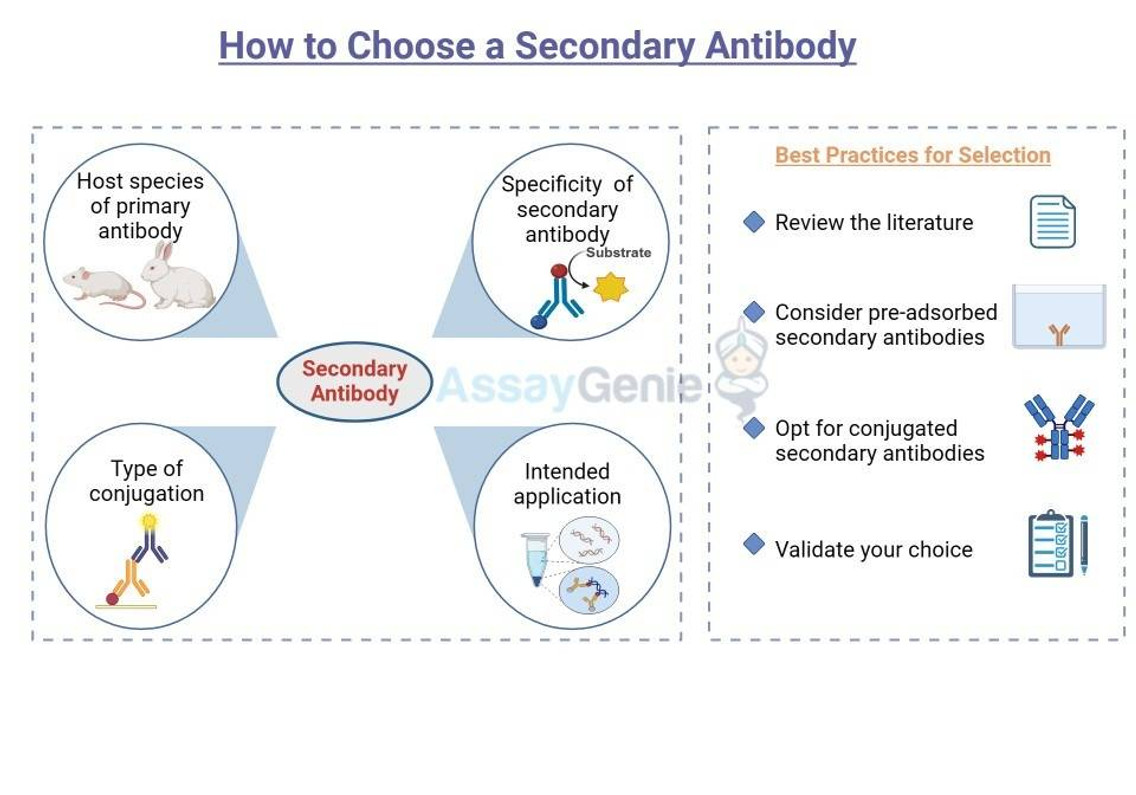
Sekundärantikörper verstehen
Sekundärantikörper sind Antikörper, die an Primärantikörper binden, die direkt an das Zielantigen gebunden sind. Sie sind typischerweise mit einem Nachweismarker wie einem Enzym oder einem Fluorophor konjugiert, was die Visualisierung des Antigen-Antikörper-Komplexes erleichtert. Die Wahl des sekundären Antikörpers hängt von mehreren Faktoren ab, darunter der Wirtsart des primären Antikörpers, der Spezifität des sekundären Antikörpers, der Art der Konjugation und der beabsichtigten Anwendung.
Wirtsspezies und Kreuzreaktivität
Eine der ersten Überlegungen bei der Auswahl eines sekundären Antikörpers ist die Wirtsspezies des primären Antikörpers. Es ist von entscheidender Bedeutung, einen sekundären Antikörper auszuwählen, der gegen die Spezies des primären Antikörpers gerichtet ist. Wenn Ihr Primärantikörper beispielsweise von Kaninchen stammt, sollten Sie einen Anti-Kaninchen-Sekundärantikörper wählen.
Kreuzreaktivität ist ein weiterer wichtiger Faktor. Idealerweise sollte der sekundäre Antikörper nicht mit endogenen Immunglobulinen der Spezies des Probengewebes oder der Probenzellen kreuzreagieren. Diese Überlegung ist besonders wichtig bei IHC- und IF-Anwendungen, bei denen endogene Immunglobuline zu unspezifischer Färbung führen können.
Konjugations- und Nachweismethoden
Die Wahl der Konjugation wird durch die Nachweismethode bestimmt. Für den kolorimetrischen Nachweis werden üblicherweise Enzyme wie Meerrettichperoxidase (HRP) oder alkalische Phosphatase (AP) verwendet. Für die Fluoreszenzdetektion werden Fluorophore wie FITC-, TRITC- oder Alexa-Fluor-Farbstoffe bevorzugt. Die Auswahl hängt von der verfügbaren Detektionsausrüstung wie Fluoreszenzmikroskopen oder Durchflusszytometern und der Notwendigkeit des Multiplexings ab, das Fluorophore mit nicht überlappenden Emissionsspektren erfordert.
Affinität und Spezifität
Die Affinität und Spezifität des sekundären Antikörpers sind entscheidend für das Erreichen hoher Signal-Rausch-Verhältnisse. Affinitätsgereinigte Sekundärantikörper werden bevorzugt, da sie eine höhere Spezifität und eine geringere Kreuzreaktivität aufweisen. Darüber hinaus werden einige Sekundärantikörper gegen andere Spezies adsorbiert, um die Kreuzreaktivität weiter zu reduzieren.
Anwendungen und Versuchsbedingungen
Die Wahl des Sekundärantikörpers wird auch von der spezifischen Anwendung und den Versuchsbedingungen beeinflusst. Beispielsweise kann beim Western Blot die Größe des Sekundärantikörpers die Wanderung des Antigen-Antikörper-Komplexes während der Elektrophorese beeinflussen. Bei IHC und IF können der Gewebetyp und die Fixierungsmethode die Zugänglichkeit des Antigens und die Wahl des sekundären Antikörpers beeinflussen.
Best Practices für die Auswahl
Um die optimale Auswahl eines Sekundärantikörpers sicherzustellen, sollten Sie die folgenden Best Practices berücksichtigen:
1. Sehen Sie sich die Literatur an, um die in ähnlichen Experimenten verwendeten Sekundärantikörper zu identifizieren.
2. Konsultieren Sie Antikörperlieferanten und nutzen Sie deren Fachwissen, um den am besten geeigneten Sekundärantikörper auszuwählen.
3. Erwägen Sie voradsorbierte Sekundärantikörper für Anwendungen, die anfällig für Kreuzreaktivität sind.
4. Entscheiden Sie sich für konjugierte Sekundärantikörper, die zu Ihrem Nachweissystem passen.
5. Bestätigen Sie Ihre Wahl, indem Sie Kontrollexperimente durchführen, um die Spezifität und Sensitivität zu bewerten.
Abschluss
Die sorgfältige Auswahl eines Sekundärantikörpers ist für den Erfolg von Immundetektionstests von entscheidender Bedeutung. Durch die Berücksichtigung von Faktoren wie der Wirtsspezies des Primärantikörpers, der Spezifität, der Konjugation und der beabsichtigten Anwendung können Forscher den am besten geeigneten Sekundärantikörper für ihre Experimente auswählen. Durch die Befolgung von Best Practices und die Durchführung von Validierungsexperimenten wird die Zuverlässigkeit und Reproduzierbarkeit der Ergebnisse zusätzlich gewährleistet.
Verweise
1. Green, NM (1990). Avidin und Streptavidin. Methoden in der Enzymologie, 184, 51-67.
2. Harlow, E. & Lane, D. (1988). Antikörper: Ein Laborhandbuch. Cold Spring Harbor Laboratory Press.
3. Hermanson, GT (2013). Biokonjugattechniken (3. Aufl.). Akademische Presse.
4. Atha, D. H., Manne, U., Grizzle, W. E., Wagner, P. D., Srivastava, S. & Reipa, V. (2010). Standards für die immunhistochemische Bildgebung: Ein Proteinreferenzgerät für die Quantifizierung von Biomarkern. Journal of Histochemistry & Cytochemistry, 58(11), 1005-1014.
5. Nerenberg, S. T. & Peetoom, F. (1970). Verwendung von Immunelektrophorese und Immundiffusion in der klinischen Medizin. CRC Critical Reviews in Clinical Laboratory Sciences, 1(2), 303-350.
6. Sambrook, J. & Russell, D. W. (2001). Molekulares Klonen: Ein Laborhandbuch (3. Aufl.). Cold Spring Harbor Laboratory Press.
7. Towbin, H., Staehelin, T. & Gordon, J. (1979). Elektrophoretische Übertragung von Proteinen von Polyacrylamidgelen auf Nitrozellulosefolien: Verfahren und einige Anwendungen. Proceedings of the National Academy of Sciences of the United States of America, 76(9), 4350-4354.
8. Chang, C. J., Yang, Y. H., Liang, Y. C., Chiu, C. J., Chu, K. H., Chou, H. N. und Chiang, B. L. (2011). Ein neuartiges Phycobiliprotein lindert allergische Atemwegsentzündungen durch Modulation der Immunantwort. American Journal of Respiratory and Critical Care Medicine, 183(1), 15-25.
10th Jul 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024