Protease vs. Peptidase: Enzymatische Verdauung verstehen
In der komplexen Welt biochemischer Prozesse spielen Enzyme eine entscheidende Rolle bei der Katalyse verschiedener lebensnotwendiger Reaktionen. Unter diesen Enzymen sind Proteasen und Peptidasen grundlegende Akteure beim Abbau von Proteinen bzw. Peptiden. Obwohl ihre Namen ähnlich klingen und sich ihre Funktionen teilweise überschneiden, dienen sie im Bereich der enzymatischen Verdauung unterschiedlichen Zwecken. Lassen Sie uns tiefer in ihre Definitionen, Funktionen und Typen eintauchen, um ein umfassendes Verständnis zu erlangen.
Protease: Die Proteinverdauer
Proteasen, auch proteolytische Enzyme oder Proteinasen genannt, sind Enzyme, die die Hydrolyse von Peptidbindungen innerhalb von Proteinen katalysieren. Diese Enzyme sind bei zahlreichen biologischen Prozessen unverzichtbar, darunter bei der Verdauung, der zellulären Signalübertragung und dem Proteinumsatz. Im Zusammenhang mit der Verdauung spielen Proteasen eine zentrale Rolle bei der Aufspaltung von Nahrungsproteinen in kleinere Peptide und Aminosäuren und erleichtern so deren Aufnahme im Darm.
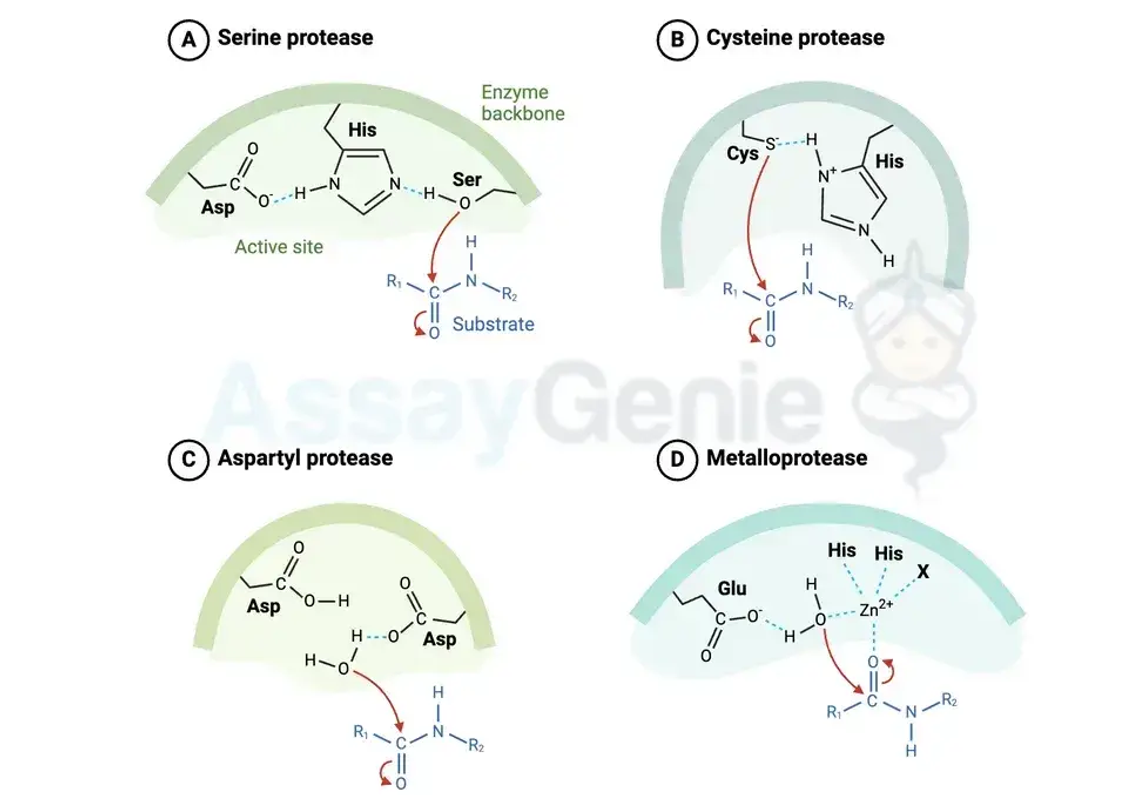
Proteasen werden basierend auf ihren katalytischen Mechanismen, optimalen pH-Bereichen und Strukturmerkmalen in mehrere Kategorien eingeteilt. Eine gängige Klassifizierung unterteilt Proteasen basierend auf ihren katalytischen Mechanismen in vier Hauptklassen:
Serinproteasen:
Diese Enzyme nutzen einen Serinrest in ihrem aktiven Zentrum, um die Spaltung der Peptidbindung zu katalysieren. Serinproteasen spielen eine entscheidende Rolle bei der Verdauung, der Blutgerinnung und der Immunantwort.
Cysteinproteasen:
Diese Proteasen nutzen einen Cysteinrest zur Katalyse und kommen in verschiedenen zellulären Prozessen vor, darunter Apoptose und Proteinabbau.
Metalloproteasen
Metalloproteasen benötigen für ihre katalytische Aktivität Metallionen wie Zink. Sie sind an verschiedenen physiologischen Funktionen beteiligt, darunter Gewebeumbau, Zellsignalisierung und Wundheilung.
Aspartyl-Proteasen:
Aspartylproteasen nutzen Asparaginsäurereste in ihren aktiven Zentren, um die Hydrolyse von Peptidbindungen zu erleichtern. Beispiele für Aspartylproteasen sind Pepsin, das im sauren Milieu des Magens die Proteinverdauung initiiert, und die HIV-Protease, die eine entscheidende Rolle bei der Replikation des humanen Immundefizienzvirus spielt.
Peptidase: Die Peptidzerleger
Peptidasen, auch Peptidhydrolasen oder Peptidylpeptidhydrolasen genannt, sind Enzyme, die für die Hydrolyse von Peptidbindungen in Peptiden und kleinen Proteinen verantwortlich sind. Während Peptidasen die übergeordnete Funktion der Spaltung von Peptidbindungen gemeinsam haben, zielen sie im Vergleich zu Proteasen hauptsächlich auf kürzere Peptidsubstrate ab.
Ähnlich wie Proteasen weisen Peptidasen eine Vielfalt in ihrer Klassifizierung auf, die auf katalytischen Mechanismen, optimalen pH-Bereichen und Substratspezifität basiert. Peptidasen können grob in Exopeptidasen und Endopeptidasen eingeteilt werden, was der Klassifizierung von Proteasen entspricht:
Exopeptidasen
Diese Enzyme spalten Peptidbindungen an den terminalen Enden von Peptiden und setzen so einzelne Aminosäuren oder Dipeptide frei. Beispiele hierfür sind Aminopeptidasen und Carboxypeptidasen.
Endopeptidasen
Endopeptidasen zielen auf interne Peptidbindungen in größeren Peptidsubstraten ab und erzeugen so kürzere Peptidfragmente. Prominente Beispiele sind Dipeptidasen und Tripeptidasen.
Ähnlich wie Proteasen weisen auch Peptidasen eine Spezifität für bestimmte Aminosäurereste neben der Peptidbindung auf, die sie spalten, was zu ihrer vielfältigen Rolle in biologischen Prozessen beiträgt.

Protease vs. Peptidase: Eine vergleichende Analyse
Während sowohl Proteasen als auch Peptidasen das gemeinsame Ziel haben, Peptidbindungen zu hydrolysieren, unterscheiden sie sich in ihrer Substratspezifität und der Größe der Peptide, auf die sie abzielen. Proteasen konzentrieren sich in erster Linie auf den Abbau größerer Proteine in kleinere Peptide, während Peptidasen darauf spezialisiert sind, diese Peptide weiter in einzelne Aminosäuren oder Dipeptide abzubauen.
Darüber hinaus weisen Proteasen im Vergleich zu Peptidasen typischerweise eine breitere Substratspezifität auf, was es ihnen ermöglicht, auf ein breites Spektrum von Proteinsubstraten einzuwirken. Im Gegensatz dazu weisen Peptidasen häufig eine höhere Spezifität für bestimmte Peptidsequenzen oder terminale Aminosäuren auf, was ihre Rolle bei der Feinabstimmung des Peptid stoffwechsels und der Signalwege widerspiegelt.
Abschluss
Zusammenfassend lässt sich sagen, dass Proteasen und Peptidasen integrale Bestandteile der enzymatischen Maschinerie sind, die für die Verdauung und den Metabolismus von Proteinen und Peptiden verantwortlich ist. Während beiden Enzymklassen die gemeinsame Funktion der Hydrolyse von Peptidbindungen gemeinsam ist, weisen sie unterschiedliche Eigenschaften hinsichtlich Substratspezifität, katalytischen Mechanismen und physiologischen Rollen auf. Das Verständnis der Unterschiede zwischen Proteasen und Peptidasen ist für das Verständnis der komplizierten Prozesse, die der enzymatischen Verdauung und dem Zellstoffwechsel zugrunde liegen, von entscheidender Bedeutung.
Verweise:
1. Takahashi, K. & Yamanaka, S. (2006). Induktion pluripotenter Stammzellen aus embryonalen und adulten Fibroblastenkulturen von Mäusen durch definierte Faktoren. Zelle, 126(4), 663-676. [DOI: 10.1016/j.cell.2006.07.024]
2. Evans, M. J. & Kaufman, M. H. (1981). Etablierung pluripotenter Zellen aus Mäuseembryonen in Kultur. Natur, 292(5819), 154-156. [DOI: 10.1038/292154a0]
3. Bianco, P., Robey, P. G. & Simmons, P. J. (2008). Mesenchymale Stammzellen: Geschichte, Konzepte und Tests noch einmal. Zellstammzelle, 2(4), 313-319. [DOI: 10.1016/j.stem.2008.03.002]
4. Thomson, J. A., Itskovitz-Eldor, J., Shapiro, S. S., Waknitz, M. A., Swiergiel, J. J., Marshall, V. S. & Jones, J. M. (1998). Aus menschlichen Blastozysten gewonnene embryonale Stammzelllinien. Science, 282(5391), 1145-1147. [DOI: 10.1126/science.282.5391.1145]
5. Wichterle, H., Lieberam, I., Porter, J. A. & Jessell, T. M. (2002). Gezielte Differenzierung embryonaler Stammzellen in Motoneuronen. Zelle, 110(3), 385-397. [DOI: 10.1016/s0092-8674(02)00835-8]
6. Weissman, I. L. & Shizuru, J. A. (2008). Die Ursprünge der Identifizierung und Isolierung hämatopoetischer Stammzellen und ihre Fähigkeit, spenderspezifische Transplantationstoleranz zu induzieren und Autoimmunerkrankungen zu behandeln. Blut, 112(9), 3543-3553. [DOI: 10.1182/blood-2008-07-078139]
7. Simonsen, J. L., Rosada, C., Serakinci, N., Justesen, J., Stenderup, K., Rattan, S. I., ... & Kassem, M. (2002). Die Expression von Telomerase verlängert die proliferative Lebensdauer und erhält das osteogene Potenzial menschlicher Knochenmarksstromazellen aufrecht. Nature Biotechnology, 20(6), 592-596. [DOI: 10.1038/nbt0602-592]
8. Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K. & Yamanaka, S. (2007). Induktion pluripotenter Stammzellen aus erwachsenen menschlichen Fibroblasten durch definierte Faktoren. Zelle, 131(5), 861-872. [DOI: 10.1016/j.cell.2007.11.019]
1st Aug 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024