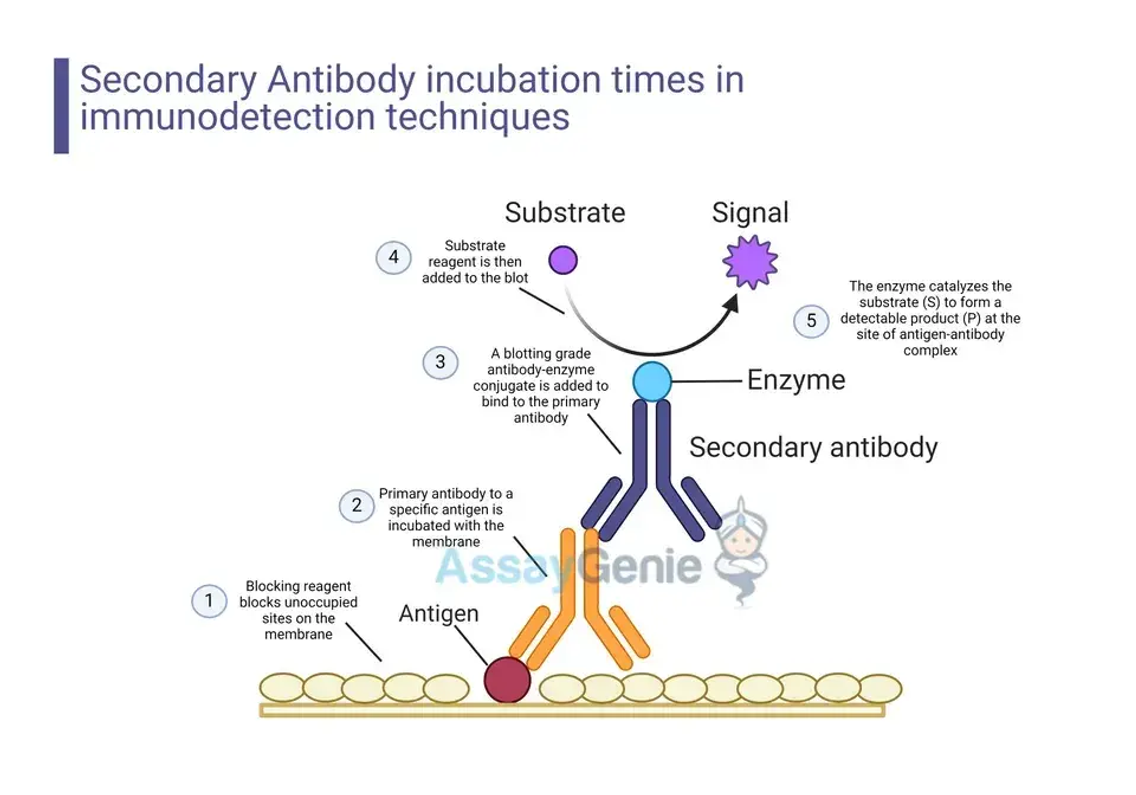
Prinzipien der Sekundärantikörper-Inkubation
Sekundärantikörper spielen beim Nachweis von Zielantigenen in verschiedenen Immunnachweistests wie Western Blot, ELISA (Enzyme-Linked Immunosorbent Assay) und Immunhistochemie (IHC) eine entscheidende Rolle. Die Wahl der Inkubationszeit des sekundären Antikörpers ist entscheidend für die Erzielung optimaler Signal-Rausch-Verhältnisse und erhöht dadurch die Spezifität und Empfindlichkeit des Assays. In diesem Artikel werden die Grundsätze für die Inkubationszeiten von Sekundärantikörpern, Faktoren, die diese Zeiten beeinflussen, und praktische Tipps zur Optimierung der Testergebnisse erläutert.
Einführung
Bei Immundetektionstests werden sekundäre Antikörper eingesetzt, um an primäre Antikörper zu binden, die das Zielantigen direkt erkennen. Diese Sekundärantikörper sind mit Enzymen oder Fluoreszenzfarbstoffen konjugiert, was die Visualisierung oder Quantifizierung der Antigen-Antikörper-Komplexe erleichtert. Die Inkubationszeit von Sekundärantikörpern beeinflusst die Wirksamkeit des Assays erheblich, wobei sowohl eine Über- als auch eine Unterinkubation zu suboptimalen Ergebnissen führt. Das Verständnis der Dynamik von Antikörper-Antigen-Wechselwirkungen und der Faktoren, die diese Wechselwirkungen beeinflussen, ist für die Bestimmung der optimalen Inkubationszeiten von entscheidender Bedeutung.

Prinzipien der Sekundärantikörper-Inkubation
- Kinetik der Antikörper-Antigen-Bindung
Die Bindung sekundärer Antikörper an primäre Antikörper wird durch die Kinetik der Antikörper-Antigen-Wechselwirkungen bestimmt. Diese Kinetik wird durch die Affinität des sekundären Antikörpers zum primären Antikörper, die Konzentration der Antikörper und die Bedingungen der Testumgebung beeinflusst. Antikörper mit hoher Affinität erfordern möglicherweise kürzere Inkubationszeiten, um eine signifikante Bindung zu erreichen, während Wechselwirkungen mit niedriger Affinität möglicherweise längere Inkubationen erfordern.
- Signalverstärkung
Sekundärantikörper sorgen für eine Signalverstärkung, ein entscheidender Aspekt beim Nachweis von Antigenen mit geringer Häufigkeit. Die Amplifikation wird durch die Bindung mehrerer sekundärer Antikörper an jeden primären Antikörper erreicht. Dieser Prozess ist zeitabhängig, wobei längere Inkubationszeiten möglicherweise die Signalintensität bis zu einem bestimmten Punkt erhöhen, ab dem es zu Sättigung oder unspezifischer Bindung kommen kann.
Faktoren, die die Inkubationszeiten von Sekundärantikörpern beeinflussen
- Antikörperkonzentration
Die Konzentration der in einem Assay verwendeten Sekundärantikörper kann sich auf die erforderliche Inkubationszeit auswirken. Höhere Konzentrationen können den Bindungsprozess beschleunigen und so die Notwendigkeit einer längeren Inkubation verringern. Allerdings können zu hohe Konzentrationen zu einem erhöhten Hintergrundrauschen führen, was eine sorgfältige Optimierung erforderlich macht.
- Temperatur
Die Inkubationstemperatur spielt eine entscheidende Rolle bei der Modulation der Kinetik von Antikörper-Antigen-Wechselwirkungen. Höhere Temperaturen können die Bindungsrate erhöhen und so kürzere Inkubationszeiten ermöglichen. Umgekehrt verlangsamen niedrigere Temperaturen diese Wechselwirkungen und erfordern oft längere Inkubationszeiten, um eine optimale Bindung zu erreichen.
- Assay-Typ
Die Art des Tests hat erheblichen Einfluss auf die optimale Inkubationszeit des Sekundärantikörpers. Beispielsweise erfordern Western Blots im Vergleich zu IHC aufgrund der unterschiedlichen Zugänglichkeit von Antigenen und der Matrixeffekte in Gewebeschnitten im Vergleich zu Membranen im Allgemeinen kürzere Inkubationszeiten.
- Antigenhäufigkeit
Die Häufigkeit des Zielantigens kann auch die erforderliche Inkubationszeit bestimmen. Ziele mit hoher Häufigkeit können mit kürzeren Inkubationszeiten effektiv erkannt werden, während Ziele mit geringer Häufigkeit möglicherweise längere Zeiträume benötigen, um eine ausreichende Signalerzeugung sicherzustellen.
Optimierung der Inkubationszeiten für Sekundärantikörper
- Empirische Tests
Angesichts der Variabilität der Faktoren, die die Inkubationszeiten beeinflussen, sind häufig empirische Tests erforderlich, um die optimale Dauer zu bestimmen. Dazu gehört die Durchführung des Assays mit unterschiedlichen Inkubationszeiten und die Beurteilung des Signal-Rausch-Verhältnisses, um den Zeitpunkt zu ermitteln, der die besten Ergebnisse liefert.
- Verwendung von Blockierungsmitteln
Blockierungsmittel können verwendet werden, um unspezifische Bindungen zu reduzieren, was möglicherweise kürzere Inkubationszeiten durch Minimierung des Hintergrundrauschens ermöglicht. Eine wirksame Blockierung kann die Spezifität der sekundären Antikörperbindung erhöhen und so die Gesamtempfindlichkeit des Assays verbessern.
- Anpassen der Antikörperkonzentrationen
Die Optimierung der Konzentration sekundärer Antikörper kann auch bei der Feinabstimmung der Inkubationszeit hilfreich sein. Niedrigere Konzentrationen können von längeren Inkubationszeiten profitieren, während höhere Konzentrationen möglicherweise schneller eine optimale Bindung erreichen, aber das Risiko höherer Hintergrundwerte bergen.
Abschluss
Die Inkubationszeit von Sekundärantikörpern ist ein entscheidender Parameter in Immundetektionstests und beeinflusst sowohl die Empfindlichkeit als auch die Spezifität des Nachweises. Durch das Verständnis der Prinzipien der Antikörper-Antigen-Wechselwirkungen und die Berücksichtigung der verschiedenen Faktoren, die diese Wechselwirkungen beeinflussen, können Forscher die Inkubationszeiten optimieren, um die Testergebnisse zu verbessern. Empirische Tests, kombiniert mit Anpassungen der Antikörperkonzentrationen und Testbedingungen, bieten einen Weg, um zuverlässige und reproduzierbare Ergebnisse zu erzielen
Verweise
1. Yannakou, L., Diamandis, E. P. & Souvatzoglou, A. (1987). Einfluss von Inkubationszeit und -temperatur auf die Interferenz von Digoxin-ähnlichen immunreaktiven Substanzen in Digoxin-Immunoassays. Therapeutische Arzneimittelüberwachung, 9(4), 461-463.
2. Jiang, W., Liu, X., Wu, D., Wang, H., Wang, Y., Chen, H. & Yuan, L. (2015). Ein einfacher, schneller Ein-Schritt-ELISA unter Verwendung eines Antikörper-Antikörper-Komplexes. Biotechnologie und angewandte Biochemie, 62(1), 126-131.
3. Simons, B., Kaplan, H. & Hefford, M. A. (2006). Neuartige vernetzte Enzym-Antikörper-Konjugate für Western Blot und ELISA. Zeitschrift für immunologische Methoden, 315(1-2), 88-98.
4. Kim, S. W., Roh, J. & Park, C. S. (2016). Immunhistochemie für Pathologen: Protokolle, Fallstricke und Tipps. Zeitschrift für Pathologie und translationale Medizin, 50(6), 411.
5. Wujcik, E. K., Wei, H., Zhang, X., Guo, J., Yan, X., Sutrave, N., ... & Guo, Z. (2014). Antikörper-Nanosensoren: eine detaillierte Übersicht. Rsc Advances, 4(82), 43725-43745.
10th Jul 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024