Neurofilament-Leichtkette (NEFL) als Biomarker für neuronale Schäden
Tauchen Sie ein in die zentrale Rolle der Neurofilament-Leichtkette (NEFL) in der Neuronenstruktur und ihre zunehmende Bedeutung als Biomarker für verschiedene neurodegenerative Erkrankungen und bieten Sie Einblicke in den Krankheitsverlauf und die Behandlungsüberwachung.
Wichtige Erkenntnisse:
1. Erkunden Sie die Bedeutung der Neurofilament-Leichtkette (NEFL) als Biomarker für neuronale Schäden und ihre Rolle bei neurodegenerativen Erkrankungen.
2. Verstehen Sie die Funktion von NEFL im neuronalen Zytoskelett, Transportmechanismen und posttranslationalen Modifikationen.
3. Entdecken Sie die Beteiligung von NEFL an Erkrankungen wie Alzheimer, ALS und der Huntington-Krankheit und sein Potenzial als Diagnoseinstrument.
Neurofilament-Leichtkette (NEFL)
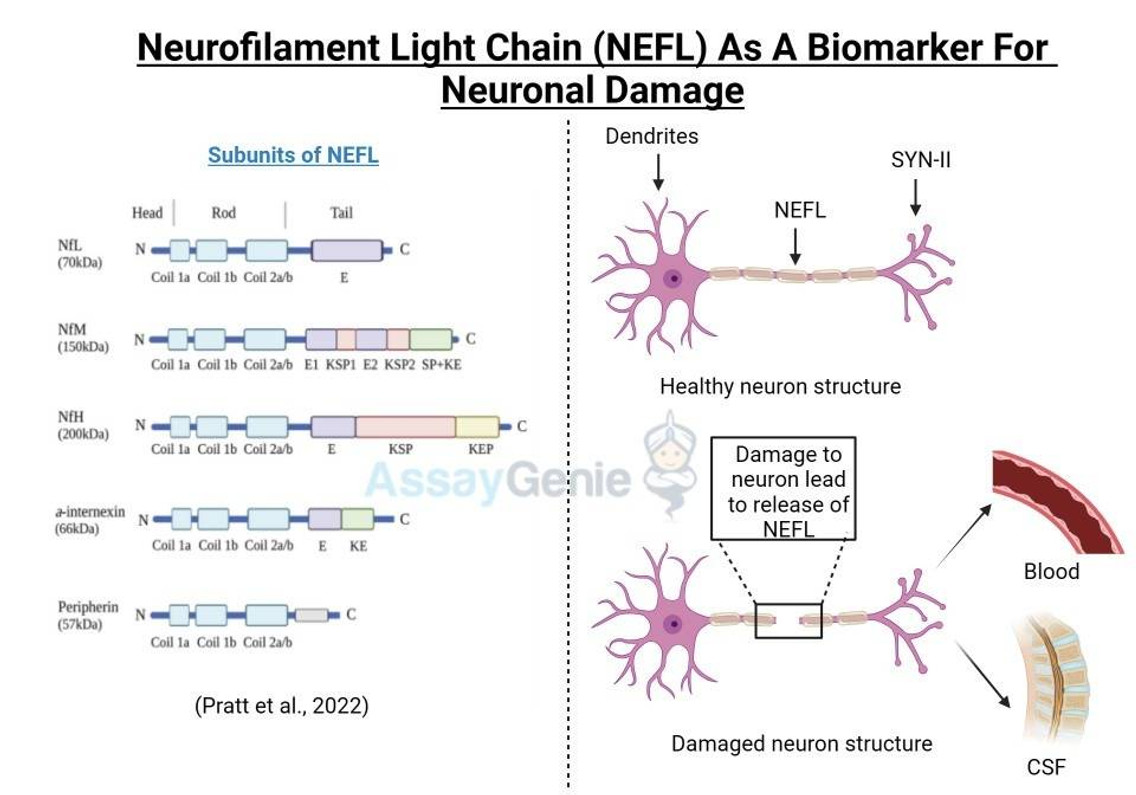
Die Neurofilament-Leichtkette (NEFL oder NfL) ist eine von drei Untereinheiten der Neurofilamentfilamente, bei denen es sich um in Neuronen exprimierte Zwischenfilamentproteine handelt, die eine zentrale Rolle beim Transport von Molekülen durch das Axon spielen und zur Integrität der neuronalen Zytoarchitektur beitragen . Das neuronale Zytoskelett enthält mehrere Filamente, die als Aktin-Mikrofilamente, Mikrotubuli und Zwischenfilamente klassifiziert werden (Ishikawa et al., 19680). Darüber hinaus werden zwei Hauptfamilien von Zwischenfilamenten im zentralen und peripheren Nervensystem (ZNS, PNS) exprimiert: Gliafilamente, wie GFAP und Vimentin; und Neurofilamente, die einen Durchmesser von etwa 10 nm haben (Cardone und Roots, 1990; Karlsson et al., 1987) bestehen außerdem aus 3 Untereinheiten; Kette, basierend auf ihren Molekulargewichten, 112,5 kDa, 102,5 kDa bzw. 61,5 kDa, obwohl sie auf Polyacrylamidgelen aufgrund des hohen Gehalts an negativ geladenen Aminosäuren in ihrer Struktur höhere Molekulargewichte aufweisen und 205 kDa, 168 kDa erreichen bzw. 68 kDa (Julien und Mushynski, 1998) wurde im ZNS eine vierte Neurofilament-Untereinheit identifiziert, die als a-Internexin bezeichnet wird, wobei sich Peripherin im PNS befindet (Yuan et al., 2006; Beaulieu et al., 1999). In den 70er Jahren wurde festgestellt, dass Neurofilamente den Durchmesser neuronaler Axone vergrößern und dadurch die elektrische Leitung und neuronale Signalübertragung erleichtern (Friede und Samorajki, 1970). Sie sind die am häufigsten vorkommenden Zytoskelettmoleküle in myelinisierten Neuronen. NEFL-H und NEFL-M sind in Abwesenheit von NEFL funktionell redundant und können keine Filamente bilden; Es wurde jedoch gezeigt, dass NEFL isoliert funktioniert (Carter et al., 1998). Die molekulare Struktur von NEFL besteht aus einer hochkonservierten Stäbchendomäne mit 310 Aminosäuren, die die Interaktion und den Zusammenbau mit anderen Neurofilament-Untereinheiten ermöglicht, und einer Mikrotubuli-Polymerisationshemmdomäne, die die Dichte der Mikrotubuli im Axon reguliert (Bocquet al, 2009). .
NEFL Transport und Verarbeitung
NEFL wird im Zellkörper des Neurons synthetisiert und zum Axon transportiert, um seinen funktionellen Ort zu erreichen. Viele Studien haben die molekularen Mechanismen untersucht, die diesen Transport steuern, wobei neuere Erkenntnisse ein „Stop-and-Go“-Modell des Neurofilamenttransports beschreiben, was darauf hindeutet, dass Axone eine einzige kinetische Population von Neurofilamenten enthalten, die sich durch Mikrotubuli in bidirektionaler Weise bewegen können Motorproteine wie Kinesin und Dynein (Yuan et al., 2015; Li et al., 2012; Prahlad et al., 2000). NEFL wird auch zurück zum Zellkörper transportiert, um dort abgebaut zu werden (Hoffman und Lasek, 1985). Eine wichtige Funktion der Stäbchendomäne von NEFL besteht darin, als Bindungsstelle für Motorproteine wie Myosin zu fungieren. Wechselwirkungen zwischen NEFL und Motorproteinen spielen eine entscheidende Rolle bei der Topographie und zellulären Lokalisierung von Organellen, einschließlich des endoplasmatischen Retikulums, der Endosomen und synaptischen Vesikel im Axon, wobei die Deletion von Myosin oder NEFL zur Herunterregulierung dieser zellulären Organellen im Axon führt Axon (Rao et al., 2011).
NEFL unterliegt mehreren posttranslationalen Modifikationen wie Phosphorylierung, Glykosylierung, Oxidation und Ubiquitinierung (Perrot et al., 2008). Die Kopfdomänen von Neurofilamenten sind glykosyliert und phosphoryliert, wobei die Phosphorylierung von NEFL den Zusammenbau von Neurofilamenten hemmt (Yates et al., 2009; Hisinaga et al., 1990). Es wird angenommen, dass es sich hierbei um einen selbstregulierenden Mechanismus handelt, da die NEFL-Phosphorylierung nach der Synthese der NEFL-Untereinheit hochreguliert wird (Sihag und Nixon, 1991). Die Phosphorylierung von NEFL wird durch die Proteinkinasen A und C (PKA und PKC) vermittelt. Der Transport entlang des Axons erfordert eine Dephosphorylierung von NEFL, die durch Proteinphosphatase 2A (PP2A) vermittelt wird (Saito et al., 1995). Eine fehlregulierte Phosphorylierung von NEFL wurde mit neurodegenerativen Erkrankungen in Verbindung gebracht (Dale und Garcia, 2012).
NEFL und Neuropathologien: Eine Rolle für NEFL als prognostischer Biomarker
Es wurde gezeigt, dass Störungen im Stoffwechsel und der zellulären Lokalisierung von NEFL sowie Nefl-Mutationen zur Pathogenese neurodegenerativer Erkrankungen wie der Alzheimer-Krankheit und der Charcot-Marie-Tooth-Krankheit beitragen (Jordanova et al., 2003; Grierson et al., 2001). In jüngerer Zeit wurde eine Erkrankung mit neuronalem Intermediate-Filament-Einschluss beschrieben, die klinisch der frontotemporalen Demenz ähnelt (Bigio et al., 2003). NEFL kann nach einer neuronalen Schädigung ausgeschüttet werden, und bei mehreren Neuropathologien wurde über erhöhte NEFL-Spiegel berichtet (Zetterberg, 2016; Perrot et al., 2008). NEFL ist ein wichtiger diagnostischer Marker für mehrere neurodegenerative Erkrankungen, wie z. B. Amyotrophe Lateralsklerose (ALS) (Rosengren et al., 1996), Multiple Sklerose (MS) (Tuenissen et al., 2009) und wurde kürzlich auch bei der Huntington-Krankheit (HD) beschrieben. (Niemela et al., 2017). Zusätzlich zur Rolle von NEFL bei neurodegenerativen Erkrankungen wird über erhöhte NEFL bei traumatischen Hirnverletzungen (TBI), Schlaganfall und HIV-assoziierter Demenz berichtet (Shahim et al., 2016; Gisslen et al., 2015). Eine kürzlich durchgeführte Studie ergab, dass NEFL als Reaktion auf angesammelte Proteineinschlüsse aus geschädigten Neuronen freigesetzt wird und effektiv aus dem Liquor ins Blut gelangt (Baciaglu et al., 2016). Dies ist die erste Studie, die die NEFL-Spiegel im Liquor und im Blut neurodegenerativer Patienten korreliert. Sie hat erhebliche Auswirkungen auf den Bereich der prädiktiven Biomarker und hat auch das Potenzial, therapeutische Behandlungen in der Klinik zu überwachen, da sie im Blut leicht zugänglich sind.

Abbildung 1: NEFL-Beteiligung an neurodegenerativen Erkrankungen. Über die Anhäufung von NEFL wurde bei mehreren neurodegenerativen Erkrankungen berichtet, beispielsweise bei der Alzheimer-Krankheit, der Amyotrophen Lateralsklerose und der Huntington-Krankheit. Es wird vermutet, dass fehlregulierte posttranslationale Modifikationen des NEFL und Mutationen im nefl-Gen zu unausgeglichenen NEFL-Spiegeln im Axon führen. NEFL kann aus beschädigten Neuronen in den Liquor freigesetzt werden. Kürzlich wurde gezeigt, dass erhöhte NEFL-Werte im Blut die des Liquorspiegels widerspiegeln, was auf das vielversprechende Potenzial der NEFL-Quantifizierung als Biomarker für Neuropathologien schließen lässt. Neuron-Umrissskizze mit freundlicher Genehmigung von Pixabay.
Schauen Sie sich unser NEFL ELISA-Kit an
Referenzen
1. Bacioglu M, Maia LF, Preische O, Schelle J, Apel A, Kaeser SA, Schweighauser M, Eninger T, Lambert M, Pilotto A, Shimshek DR, Neumann U, Kahle PJ, Staufenbiel M, Neumann M, Maetzler W, Kuhle J, Jucker M. Neurofilament-Leichtkette in Blut und Liquor als Marker für das Fortschreiten der Krankheit in Mausmodellen und bei neurodegenerativen Erkrankungen. Neuron. 2016. 91(1):56-66.
2. Beaulieu JM, Robertson J, Julien JP. Wechselwirkungen zwischen Peripherin und Neurofilamenten in kultivierten Zellen: Störung der Peripherinassemblierung durch die NF-M- und NF-H-Untereinheiten. Biochem Zellbiol. 1999;77(1):41-5.
3. Bigio EH, Lipton AM, White CL 3rd, Dickson DW, Hirano A. Frontotemporale und motorische Neuronendegeneration mit Neurofilament-Einschlusskörperchen: zusätzliche Hinweise auf Überlappung zwischen FTD und ALS. Neuropathol Appl Neurobiol. 2003. 29(3):239-53.
4. Bocquet A, Berges R, Frank R, Robert P, Peterson AC, Eyer J. Neurofilamente binden Tubulin und modulieren seine Polymerisation. J Neurosci. 2009. 29(35):11043-54.
5. Cardone B, Roots BI. Vergleichende immunhistochemische Untersuchung von Gliafilamentproteinen (Gliafibrilläres saures Protein und Vimentin) bei Goldfischen, Tintenfischen und Schnecken. Glia. 1990. 3(3):180-92.
6. Carter J, Gragerov A, Konvicka K, Elder G, Weinstein H, Lazzarini RA. Neurofilament (NF)-Anordnung; unterschiedliche Eigenschaften der NF-L-Untereinheiten von Menschen und Nagetieren. J Biol. Chem. 1998. 273:5101–5108
7. Dale JM, Garcia ML. Neurofilament-Phosphorylierung während der Entwicklung und Krankheit: Was war zuerst, die Phosphorylierung oder die Akkumulation? J Aminosäuren. 2012. 382107.
8. Friede RL, Samorajski T. Axon-Kaliber im Zusammenhang mit Neurofilamenten und Mikrotubuli in Ischiasnervenfasern von Ratten und Mäusen. Anat Rec. 1970. 167(4):379-87.
9. Gaiottino J, Norgren N, Dobson R, Topping J, Nissim A, Malaspina A, Bestwick JP, Monsch AU, Regeniter A, Lindberg RL, Kappos L, Leppert D, Petzold A, Giovannoni G, Kuhle J. Erhöhtes Neurofilamentlicht Kettenblutspiegel bei neurodegenerativen neurologischen Erkrankungen. PLoS One. 2013. 8(9):e75091.
10. Gisslén M, Price RW, Andreasson U, Norgren N, Nilsson S, Hagberg L, Fuchs D, Spudich S, Blennow K, Zetterberg H. Die Plasmakonzentration des Neurofilament Light Protein (NFL) ist ein Biomarker für ZNS-Verletzungen bei HIV Infektion: Eine Querschnittsstudie. EBioMedizin. 2015. 3:135-140.
3rd Sep 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024