Mitophagie: Die Aufräummannschaft der Zelle für ein gesundes Leben
Mitophagie, ein Begriff, der sich aus der Verschmelzung von „Mitochondrien“ und „Autophagie“ ableitet, stellt einen lebenswichtigen zellulären Prozess dar, der für den gezielten Abbau und die Wiederverwertung dysfunktionaler Mitochondrien verantwortlich ist. Mitochondrien, oft als Kraftwerke der Zelle bezeichnet, spielen eine entscheidende Rolle bei der Energieproduktion, der Kalziumhomöostase und der Apoptoseregulation. Allerdings kann ihre Funktionalität durch verschiedene Stressfaktoren beeinträchtigt werden, was zur Ansammlung geschädigter Mitochondrien führt. Um die Gesundheit und Funktionalität der Zellen aufrechtzuerhalten, nutzen Zellen die Mitophagie als Mechanismus, um sich von diesen dysfunktionalen Organellen zu befreien. In diesem Artikel befassen wir uns mit den Feinheiten der Mitophagie und erforschen ihre molekularen Mechanismen, ihre Bedeutung für Gesundheit und Krankheit sowie mögliche therapeutische Implikationen.
Molekulare Maschinerie der Mitophagie
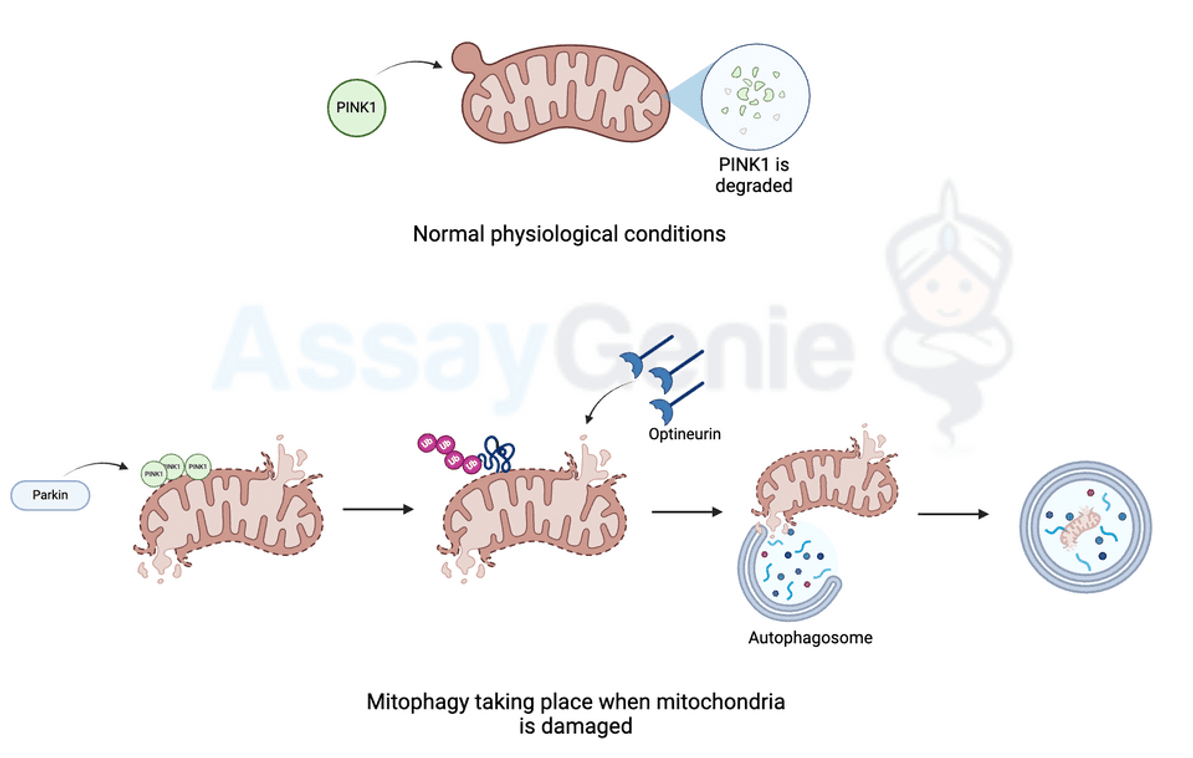
Mitophagie ist ein fein orchestrierter Prozess, an dem eine Vielzahl molekularer Akteure beteiligt sind. Einer der wichtigsten Regulatoren der Mitophagie ist die PTEN-induzierte mutmaßliche Kinase 1 (PINK1), ein Protein, das mit der Parkinson-Krankheit assoziiert ist. Unter normalen physiologischen Bedingungen wird PINK1 in die Mitochondrien importiert und anschließend durch Proteasen abgebaut. Wenn Mitochondrien jedoch beschädigt oder depolarisiert sind, reichert sich PINK1 an der äußeren Mitochondrienmembran (OMM) an. Diese Anhäufung dient als Signal für die Rekrutierung eines weiteren entscheidenden Akteurs, der E3-Ubiquitin-Ligase Parkin.
Bei der Translokation in die Mitochondrien ubiquitiniert Parkin verschiedene OMM-Proteine und markiert so die beschädigten Mitochondrien für den Abbau. Diese Ubiquitinketten fungieren als Leuchtfeuer für die Rekrutierung von Autophagierezeptoren wie p62/SQSTM1 und Optineurin. Diese Rezeptoren wiederum verbinden die ubiquitinierten Mitochondrien mit der autophagosomalen Membran und erleichtern so deren Aufnahme in Autophagosomen. Anschließend verschmelzen diese Autophagosomen mit Lysosomen und bilden Autolysosomen, in denen die umhüllten Mitochondrien durch lysosomale Hydrolasen abgebaut werden, was zur Wiederverwertung ihrer Bestandteile führt.
Regulierung der Mitophagie
Die Mitophagie wird streng reguliert, um sicherzustellen, dass sie genau dann auftritt, wenn sie benötigt wird, und um eine fehlerhafte Aktivierung zu verhindern, die zu schädlichen Auswirkungen führen könnte. Verschiedene Signalwege und posttranslationale Modifikationen modulieren die Aktivität von Mitophagie-Regulatoren. Beispielsweise fördert die AMP-aktivierte Proteinkinase (AMPK), ein Sensor für den zellulären Energiestatus, die Mitophagie unter Energiemangelbedingungen, indem sie die Unc-51-ähnliche Kinase 1 (ULK1) aktiviert, einen wichtigen Auslöser der Autophagie.
Darüber hinaus unterliegen mehrere Mitophagierezeptoren, darunter p62/SQSTM1 und NIX/BNIP3L, einer Phosphorylierung, Ubiquitinierung und Acetylierung, die ihre Bindungsaffinität zu ubiquitinierten Mitochondrien und autophagosomalen Membranen beeinflussen. Darüber hinaus spielen mitochondriale Dynamiken wie Spaltungs- und Fusionsereignisse eine entscheidende Rolle bei der Regulierung der Mitophagie. Eine übermäßige Mitochondrienspaltung fördert die Trennung beschädigter Mitochondrien und erleichtert deren Erkennung und anschließenden Abbau durch Mitophagie.
Bedeutung der Mitophagie für Gesundheit und Krankheit
Mitophagie ist für die zelluläre Homöostase und die Gesundheit des Organismus unverzichtbar. Durch die Eliminierung dysfunktionaler Mitochondrien verhindert die Mitophagie die Ansammlung reaktiver Sauerstoffspezies (ROS) und die Freisetzung proapoptotischer Faktoren und mildert so oxidativen Stress und apoptotischen Zelltod. Darüber hinaus sorgt die Mitophagie für die Erneuerung der Mitochondrien und erleichtert so die Aufrechterhaltung einer optimalen Mitochondrienfunktion und eines optimalen Zellstoffwechsels.
Eine Fehlregulation der Mitophagie wird mit verschiedenen pathologischen Zuständen in Verbindung gebracht, darunter neurodegenerative Störungen, Stoffwechselerkrankungen und Krebs. Bei der Parkinson-Krankheit beeinträchtigen Mutationen in den Genen PINK1 und Parkin die Mitophagie, was zur Anhäufung beschädigter Mitochondrien und zur neuronalen Degeneration führt. In ähnlicher Weise wurden Defekte in der Mitophagie bei der Alzheimer-Krankheit, der amyotrophen Lateralsklerose (ALS) und der Huntington-Krankheit beobachtet, was die Bedeutung der Mitophagie für die neuronale Gesundheit und das Überleben unterstreicht.
Darüber hinaus wurden Störungen der Mitophagie mit Stoffwechselstörungen wie Diabetes und Fettleibigkeit in Verbindung gebracht. Eine gestörte Mitophagie verschlimmert die mitochondriale Dysfunktion und die Insulinresistenz in peripheren Geweben und trägt so zur Pathogenese von Stoffwechselerkrankungen bei. Darüber hinaus fördert eine beeinträchtigte Mitophagie die Tumorentstehung, indem sie die Neuprogrammierung des Stoffwechsels erleichtert, Apoptose umgeht und die Proliferation und Metastasierung von Tumorzellen fördert.
Therapeutische Implikationen der Modulation der Mitophagie
Angesichts der zentralen Rolle der Mitophagie für Gesundheit und Krankheit ist die gezielte Behandlung dieses Prozesses vielversprechend für therapeutische Interventionen. Strategien zur Verbesserung der Mitophagie könnten möglicherweise die mitochondriale Dysfunktion lindern und das Fortschreiten der Krankheit bei verschiedenen pathologischen Zuständen verbessern. Pharmakologische Wirkstoffe, die Mitophagie-Signalwege aktivieren, wie Rapamycin und Carbamazepin, haben in präklinischen Modellen neurodegenerativer Erkrankungen positive Wirkungen gezeigt.
Darüber hinaus wurde gezeigt, dass Lebensstilinterventionen wie Kalorieneinschränkung und Bewegung die Mitophagie stimulieren und die Gesundheit der Mitochondrien fördern. Darüber hinaus bergen gentherapeutische Ansätze, die auf Mitophagie-Regulatoren abzielen, Potenzial für die Behandlung mitochondrialer Störungen und neurodegenerativer Erkrankungen. Die Entwicklung sicherer und wirksamer auf die Mitophagie ausgerichteter Therapien erfordert jedoch ein umfassendes Verständnis der molekularen Mechanismen, die diesem Prozess und seiner komplexen Regulation zugrunde liegen.
Abschluss:
Mitophagie stellt einen grundlegenden zellulären Prozess dar, der für die Aufrechterhaltung der mitochondrialen Qualitätskontrolle und der zellulären Homöostase unerlässlich ist. Durch die selektive Eliminierung dysfunktionaler Mitochondrien spielt die Mitophagie eine entscheidende Rolle bei der Minderung von oxidativem Stress, der Verhinderung von Apoptose und der Wahrung der Zellintegrität. Eine Fehlregulation der Mitophagie hat tiefgreifende Auswirkungen auf die menschliche Gesundheit und trägt zur Pathogenese neurodegenerativer Erkrankungen, Stoffwechselstörungen und Krebs bei.
Das Verständnis der molekularen Mechanismen, die der Mitophagie und ihrer Regulation zugrunde liegen, liefert Einblicke in mögliche Therapiestrategien zur Linderung mitochondrialer Dysfunktion und zur Bekämpfung damit verbundener Krankheiten. Die Nutzung des therapeutischen Potenzials der Mitophagie-Modulation verspricht die Entwicklung neuartiger Behandlungen für eine Vielzahl pathologischer Erkrankungen und ebnet so den Weg zu mehr Gesundheit und Langlebigkeit.
Verweise:
1. Narendra DP, Jin SM, Tanaka A, et al. PINK1 wird selektiv auf beeinträchtigten Mitochondrien stabilisiert, um Parkin zu aktivieren. PLoS-Biologie. 2008;6(1):e1000298. doi:10.1371/journal.pbio.1000298
2. Youle RJ, Narendra DP. Mechanismen der Mitophagie. Nature Reviews Molekulare Zellbiologie. 2011;12(1):9-14. doi:10.1038/nrm3028
3. Pickrell AM, Youle RJ. Die Rolle von PINK1, Parkin und mitochondrialer Treue bei der Parkinson-Krankheit. Neuron. 2015;85(2):257-273. doi:10.1016/j.neuron.2014.12.007
4. Ashrafi G, Schwarz TL. Die Wege der Mitophagie zur Qualitätskontrolle und Clearance von Mitochondrien. Zelltod und Differenzierung. 2013;20(1):31-42. doi:10.1038/cdd.2012.81
5. Palikaras K, Lionaki E, Tavernarakis N. Mechanismen der Mitophagie in der zellulären Homöostase, Physiologie und Pathologie. Naturzellbiologie. 2018;20(9):1013-1022. doi:10.1038/s41556-018-0176-2
4th Jul 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024