Makrophagenaktivierung: Ein Schlüsselfaktor für die Immunantwort und das therapeutische Potenzial
Im komplexen Geflecht des Immunsystems spielen Makrophagen eine zentrale Rolle, indem sie eine Vielzahl biologischer Reaktionen steuern, die den Körper vor Krankheitserregern schützen, Zelltrümmer entfernen und die Gewebereparatur fördern. Die Aktivierung von Makrophagen ist ein komplexer Prozess, der sowohl für die angeborene als auch für die adaptive Immunität von wesentlicher Bedeutung ist, den Krankheitsverlauf beeinflusst und vielversprechende Möglichkeiten für therapeutische Interventionen bietet. Diese umfassende Untersuchung befasst sich mit den Mechanismen der Makrophagenaktivierung, ihrer dualistischen Natur und den Auswirkungen auf die Krankheitsbehandlung und Immunmodulation.
Die Grundlagen der Makrophagenaktivierung:
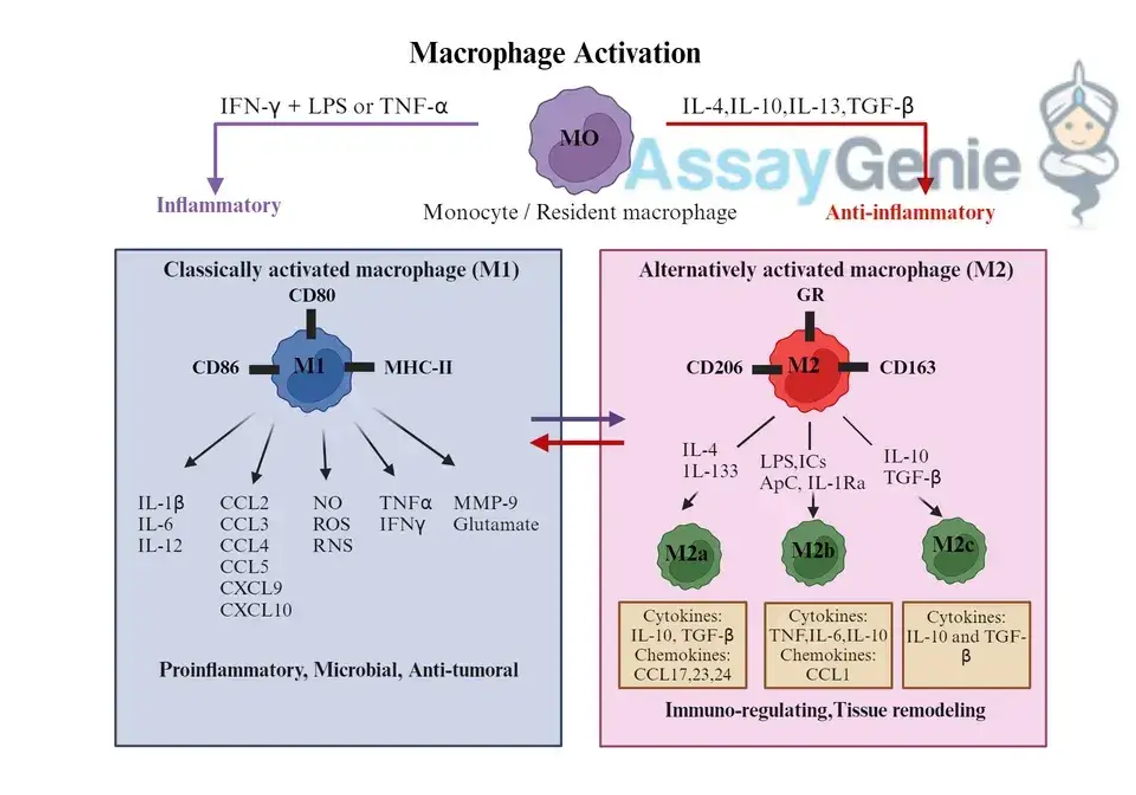
Makrophagen, abgeleitet von Monozyten, sind vielseitige Zellen, die in praktisch allen Geweben vorkommen. Sie sind auf eine schnelle Reaktion auf Infektionen und Verletzungen vorbereitet und in der Lage, je nach Umwelteinflüssen verschiedene Aktivierungszustände anzunehmen. Die klassischen Aktivierungsparadigmen (M1) und alternativen Aktivierungsparadigmen (M2) verkörpern die funktionelle Plastizität von Makrophagen, die jeweils auf spezifische Immunherausforderungen zugeschnitten sind.

Grundlagen der Makrophagenaktivierung
Klassische Aktivierung: Die Krieger der angeborenen Immunität
M1-Makrophagen entstehen als Reaktion auf entzündungsfördernde Reize wie Lipopolysaccharide (LPS) und Interferon-Gamma (IFN-γ), die typischerweise mit einer mikrobiellen Invasion und Th1-Immunantworten verbunden sind. Diese Makrophagen zeichnen sich durch ihre starken mikrobiziden Eigenschaften, die Produktion entzündungsfördernder Zytokine (z. B. TNF-α, IL-1β, IL-6) und die Fähigkeit zur Präsentation von Antigenen aus und spielen eine entscheidende Rolle bei der anfänglichen Abwehr von Krankheitserregern Gestaltung der adaptiven Immunität.
Alternative Aktivierung: Die Heiler und Regulatoren
Umgekehrt entstehen M2-Makrophagen unter entzündungshemmenden Bedingungen, angetrieben durch Zytokine wie IL-4 und IL-13, die mit Th2-Reaktionen verbunden sind. M2-Makrophagen erleichtern die Wundheilung, den Gewebeumbau und die Auflösung von Entzündungen. Sie sezernieren entzündungshemmende Zytokine (z. B. IL-10, TGF-β) und Wachstumsfaktoren und helfen so bei der Reparatur geschädigten Gewebes und der Aufrechterhaltung der Homöostase. Der M2-Phänotyp ist weiter in mehrere Untergruppen (M2a, M2b, M2c) unterteilt, von denen jede unterschiedliche Funktionen bei der Immunregulation hat, von der Förderung der Angiogenese bis zur Unterdrückung von Immunantworten.
Die Dichotomie der Makrophagenaktivierung in Krankheit und Gesundheit:
Das Gleichgewicht zwischen M1- und M2-Makrophagenaktivitäten ist entscheidend für den Ausgang verschiedener Krankheiten. Während der M1-Phänotyp für die Bekämpfung von Infektionen und Krebs unerlässlich ist, kann seine Überaktivierung zu chronischen Entzündungen, Gewebeschäden und Autoimmunerkrankungen führen. Andererseits kann eine übermäßige oder unangemessene M2-Aktivierung Immunreaktionen gegen Krankheitserreger und Tumore unterdrücken und so zu Infektionsanfälligkeit, Tumorprogression und Fibrose beitragen.
Entzündliche und Autoimmunerkrankungen:
Bei Krankheiten wie rheumatoider Arthritis, entzündlichen Darmerkrankungen und Arteriosklerose trägt ein Ungleichgewicht, das die M1-Makrophagenaktivität begünstigt, zu chronischen Entzündungen und Gewebezerstörung bei. Therapeutische Strategien, die darauf abzielen, die Makrophagenaktivierung zu modulieren, eine Verschiebung hin zum M2-Phänotyp zu fördern oder M1-vermittelte Entzündungen zu dämpfen, sind vielversprechend für die Linderung dieser Erkrankungen.
- Krebs
Die Rolle von Makrophagen bei Krebs ist paradox. Während M1-Makrophagen tumorizide Wirkungen ausüben können, unterstützen M2-Makrophagen innerhalb der Tumormikroumgebung häufig das Tumorwachstum, die Angiogenese und die Metastasierung. Die gezielte Aktivierung von Makrophagenzuständen, entweder durch Hemmung M2-assoziierter Signale oder durch Umprogrammierung tumorassoziierter Makrophagen in Richtung eines M1-ähnlichen Phänotyps, stellt einen neuartigen Ansatz in der Krebstherapie dar.
- Infektionskrankheiten
Eine wirksame Reaktion auf Infektionserreger erfordert eine ausgewogene Makrophagenreaktion, wobei M1-Makrophagen Krankheitserreger eliminieren und M2-Makrophagen Entzündungen auflösen und Gewebe reparieren. Bei chronischen Infektionen oder solchen, die durch intrazelluläre Krankheitserreger verursacht werden, kann die Manipulation der Makrophagenaktivierung die Beseitigung von Krankheitserregern verbessern und die Ergebnisse verbessern.
Therapeutische Implikationen und zukünftige Richtungen:
Das Verständnis der regulatorischen Mechanismen und Konsequenzen der Makrophagenaktivierung hat neue therapeutische Horizonte eröffnet. Derzeit werden Biologika untersucht, die auf Zytokine oder deren Rezeptoren abzielen, niedermolekulare Inhibitoren, die Signalwege beeinflussen, und Zelltherapieansätze, die auf die Modulation von Makrophagenfunktionen abzielen. Beispielsweise ist die Nutzung der Plastizität von Makrophagen zur Förderung der Regeneration bei degenerativen Erkrankungen oder zur Lösung chronischer Entzündungen ohne Beeinträchtigung der Abwehr von Krankheitserregern ein wichtiger Schwerpunkt der aktuellen Forschung.
Immunmodulation in der Therapie:
Die Fähigkeit, die Makrophagenaktivierung auf einen gewünschten Phänotyp auszurichten, hat enorme Auswirkungen auf die Behandlung einer Vielzahl von Krankheiten. Bei Krebs bergen Therapien, die M1-Makrophagen aktivieren oder die unterdrückende Tumormikroumgebung umkehren, das Potenzial für synergistische Effekte mit traditioneller Chemotherapie und Immuntherapie. Umgekehrt können bei Autoimmunerkrankungen Strategien, die die M2-Aktivierung fördern, dazu beitragen, Entzündungen und Autoimmunität zu reduzieren.
Herausforderungen und Möglichkeiten:
Eine der größten Herausforderungen bei der therapeutischen Bekämpfung der Makrophagenaktivierung ist die Komplexität des Immunsystems und die pleiotropen Wirkungen von Makrophagen. Die Entwicklung gezielter Therapien, die die Makrophagenfunktion modulieren können, ohne das Immungleichgewicht zu stören, ist von entscheidender Bedeutung. Darüber hinaus sind das Verständnis der Hinweise, die die Plastizität von Makrophagen steuern, und die Identifizierung spezifischer Marker für verschiedene Aktivierungszustände Bereiche laufender Forschung. Das aufstrebende Gebiet der Neuprogrammierung von Makrophagen bietet in Kombination mit Fortschritten in der Genomik und Proteomik vielversprechende Strategien für die präzise Manipulation von Makrophagenfunktionen.
Abschluss
Die Aktivierung von Makrophagen spielt eine zentrale Rolle bei der Reaktion des Immunsystems auf Krankheitserreger, Verletzungen und Krankheiten. Die dualistische Natur der Makrophagenaktivierung, die sowohl entzündungsfördernde als auch entzündungshemmende Zustände verkörpert, unterstreicht die Komplexität und Vielseitigkeit dieser Zellen bei der Aufrechterhaltung der Homöostase und der Reaktion auf Herausforderungen. Während die Forschung weiterhin die Mechanismen entschlüsselt, die der Makrophagenplastizität zugrunde liegen, und ihre Auswirkungen auf Gesundheit und Krankheit, ist das Potenzial für therapeutische Interventionen, die auf Makrophagenaktivierungszustände abzielen, enorm. Durch die Nutzung der Kraft von Makrophagen stehen der Zukunft der Immuntherapie, der regenerativen Medizin und der Krankheitsbehandlung bedeutende Fortschritte bevor, die Hoffnung auf neuartige und wirksamere Therapiestrategien gegen ein breites Spektrum von Krankheiten geben.
Verweise
1. Martinez, F.O., Sica, A., Mantovani, A., Locati, M. (2008). Aktivierung und Polarisation von Makrophagen. Frontiers in Bioscience, 13, 453-461.
2. Gordon, S., Taylor, P.R. (2005). Heterogenität von Monozyten und Makrophagen. Nature Reviews Immunology, 5(12), 953-964.
3. Murray, P.J., Allen, J.E., Biswas, S.K., Fisher, E.A., Gilroy, D.W., Goerdt, S., Gordon, S., Hamilton, J.A., Ivashkiv, L.B., Lawrence, T., Locati, M., Mantovani, A., Martinez, F.O., Mege, J.L., Mosser, D.M., Natoli, G., Saeij, J.P., Schultze, J.L., Shirey, K.A., Sica, A., Suttles, J., Udalova, I., van Ginderachter, J.A., Vogel, S.N., Wynn, T.A. (2014). Aktivierung und Polarisation von Makrophagen: Nomenklatur und experimentelle Richtlinien. Immunität, 41(1), 14-20.
4. Wynn, T.A., Chawla, A., Pollard, J.W. (2013). Makrophagenbiologie in Entwicklung, Homöostase und Krankheit. Natur, 496(7446), 445-455.
5. Mantovani, A., Biswas, S.K., Galdiero, M.R., Sica, A., Locati, M. (2013). Makrophagenplastizität und Polarisation bei der Gewebereparatur und -umgestaltung. Journal of Pathology, 229(2), 176-185.
6. Qian, B.Z., Pollard, J.W. (2010). Makrophagenvielfalt fördert Tumorprogression und Metastasierung. Zelle, 141(1), 39-51.
7. Lawrence, T., Natoli, G. (2011). Transkriptionelle Regulierung der Makrophagenpolarisierung: Vielfalt mit Identität ermöglichen. Nature Reviews Immunology, 11(11), 750-761.
8. Biswas, S. K., Mantovani, A. (2010). Makrophagenplastizität und Interaktion mit Lymphozyten-Untergruppen: Krebs als Paradigma. Nature Immunology, 11(10), 889-896.
25th Jul 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024