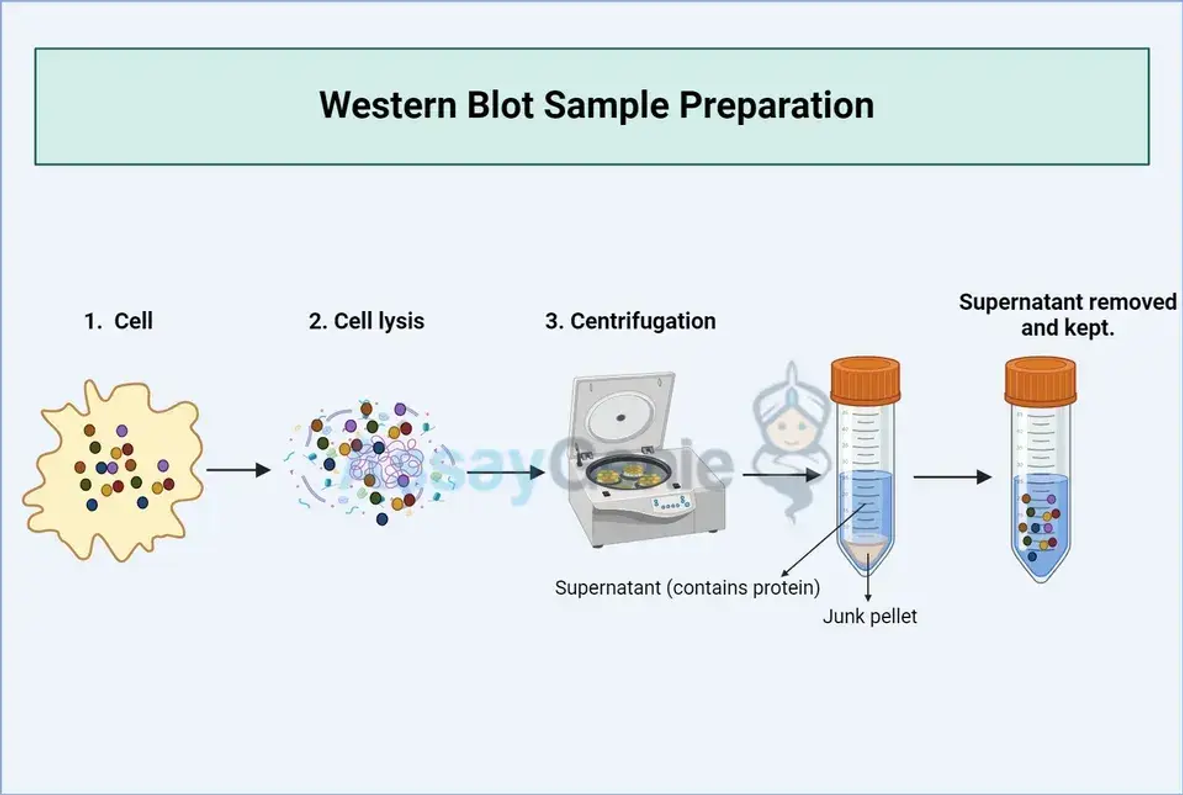
Leitfaden zur Western-Blot-Probenvorbereitung
Western Blot bleibt eine zentrale Technik in den molekularen Biowissenschaften für den Nachweis, die Quantifizierung und die Analyse von Proteinen. Sein Nutzen erstreckt sich über zahlreiche Bereiche, darunter Immunologie, Entwicklungsbiologie und Krankheitsdiagnostik. Ein entscheidender Erfolgsfaktor beim Western Blot ist die Qualität der Probenvorbereitung. Dieser Leitfaden befasst sich mit den Nuancen der Probenvorbereitung für die Western-Blot-Analyse und stellt sicher, dass Forscher reproduzierbare und aussagekräftige Ergebnisse erzielen können.
Wichtige zu besprechende Punkte
1. Einführung in das Western Blot
2. Probenentnahme und -lagerung
3. Proteinquantifizierung
4. Vorbereitung und Verwendung des Probenpuffers
5. Probendenaturierung und -beladung
6. Fehlerbehebung bei häufigen Problemen bei der Probenvorbereitung
1. Einführung in das Western Blot
Western Blot dient als grundlegendes Werkzeug zur Proteinidentifizierung und -quantifizierung in komplexen biologischen Proben. Es beruht auf der Trennung von Proteinen durch Gelelektrophorese, gefolgt von deren Übertragung auf eine Membran und dem spezifischen Nachweis mithilfe von Antikörpern. Der Erfolg der Technik hängt von einer sorgfältigen Probenvorbereitung ab, die die Integrität der Proteine bewahrt und ihre Nachweisbarkeit beibehält.
2. Probenentnahme und -lagerung
Optimale Techniken zur Probenentnahme
Eine effektive Probensammlung ist von größter Bedeutung. Stellen Sie bei Zellkulturen sicher, dass die Zellen unter Bedingungen lysiert werden, die die Protease aktivität minimieren und die Proteinstruktur aufrechterhalten. Gewebeproben sollten in einem Lysepuffer, der Proteaseinhibitoren enthält, homogenisiert werden, um einen Abbau zu verhindern. Bei Flüssigkeiten wie Blut oder Serum wird eine sofortige Verarbeitung oder Lagerung bei -80 °C empfohlen, um eine Proteolyse zu verhindern.

Lagerbedingungen für Proteinstabilität
Proteine sind außerhalb ihrer natürlichen Umgebung von Natur aus instabil. Frieren Sie die Proben sofort nach der Entnahme ein und lagern Sie sie bei -80 °C, um ihre Integrität zu bewahren. Der Zusatz von Proteaseinhibitoren zu Lysepuffern ist entscheidend für die Hemmung des enzymatischen Abbaus.
3. Proteinquantifizierung
Bedeutung der Bestimmung der Proteinkonzentration
Eine genaue Proteinquantifizierung stellt eine gleichmäßige Proteinbeladung über alle Gelspuren hinweg sicher, ein entscheidender Faktor für vergleichende Analysen. Unterschiede in der Beladung können zu Fehlinterpretationen der Proteinhäufigkeit führen.
Methoden zur Proteinquantifizierung
Für die Proteinquantifizierung stehen mehrere Assays zur Verfügung, darunter die Bradford-, BCA- und Lowry-Methoden. Jeder hat seine Vorteile und Grenzen, wobei der Bradford-Assay trotz seiner Empfindlichkeit gegenüber der Anwesenheit von Detergenzien wegen seiner Einfachheit und Geschwindigkeit beliebt ist.
4. Vorbereitung und Verwendung des Probenpuffers
Rolle des Probenpuffers beim Western Blot
Probenpuffer enthalten SDS (Natriumdodecylsulfat), um Proteine zu denaturieren und ihnen eine negative Ladung proportional zu ihrer Länge zu verleihen. Dadurch wird sichergestellt, dass sich die Proteine während der Elektrophorese nach Größe trennen.
Probenpuffer vorbereiten und verwenden
Ein typischer Probenpuffer umfasst Tris-HCl, SDS, Glycerin und einen Tracking-Farbstoff. Reduktionsmittel wie β-Mercaptoethanol oder DTT werden hinzugefügt, um Disulfidbindungen aufzubrechen und die Proteine vollständig zu denaturieren.
5. Denaturierung und Beladung der Probe
Denaturierende Proteine für die Elektrophorese
Das Erhitzen von Proben in Probenpuffer bei 95–100 °C für 5–10 Minuten ist die Standardpraxis für die Denaturierung. Dieser Schritt stellt sicher, dass sich Proteine in lineare Moleküle entfalten, was ihre Trennung nach Größe erleichtert.
Laden von Proben in das Gel
Beim Laden von Proben ist es wichtig, in allen Vertiefungen ein einheitliches Volumen zu verwenden und eine Proteinleiter als Größenreferenz einzubeziehen. Die richtige Beladungstechnik verhindert ein Verschütten und gewährleistet eine genaue Bestimmung des Molekulargewichts.
6. Fehlerbehebung bei häufigen Problemen bei der ProbenvorbereitungBekämpfung des Proteinabbaus
Wenn ein Proteinabbau beobachtet wird, überprüfen Sie den gesamten Probenvorbereitungsprozess auf mögliche Quellen für Proteaseaktivität. Stellen Sie sicher, dass frische Proteaseinhibitor-Cocktails verwendet werden und dass die Proben nach Möglichkeit auf Eis aufbewahrt werden.
Probleme beim Laden von Proben lösen
Ungleichmäßige Beladung kann häufig durch sorgfältiges Pipettieren und die Verwendung von Beladungsführungen korrigiert werden. Stellen Sie sicher, dass die Pipette kalibriert ist und die Gelvertiefungen nicht überladen sind.
Überwindung einer schlechten Proteinübertragung
Eine effiziente Übertragung vom Gel zur Membran kann durch verschiedene Faktoren behindert werden, darunter Spannungseinstellungen, Zusammensetzung des Übertragungspuffers und Membrantyp. Durch die Optimierung dieser Parameter kann die Übertragungseffizienz erheblich verbessert werden.
Practical Table for Sample Preparation
Schritt | Chemikalien/Reagenzien | Verfahren |
Musterkollektion | RIPA-Puffer, Proteasehemmer | Gewebe homogenisieren, Zellen lysieren, Körperflüssigkeiten sammeln. |
Protein-Quantifizierung | Bradford- oder BCA-Assay-Reagenzien | Proben mit Assay-Reagenzien mischen, inkubieren, Absorption messen. |
Vorbereitung des Probenpuffers | Laemmli-Puffer, β-Mercaptoethanol/DVB-T | Proben mit 1x Puffer mischen, zur Denaturierung erhitzen. |
Laden von Proben | Vorbereitete Proben, Pipette | Laden Sie gleiche Volumina/Proteinmengen in die Wells. |
Abschluss
Western Blot ist eine robuste Technik zur Proteinanalyse, die eine sorgfältige Probenvorbereitung erfordert. Durch die Befolgung der in diesem Leitfaden dargelegten Richtlinien können Forscher die Qualität und Interpretierbarkeit ihrer Western-Blot-Ergebnisse verbessern und wertvolle Einblicke in ihre Forschungsgebiete gewinnen.
Verweise
1. Bradford, M.M. (1976). Eine schnelle und empfindliche Methode zur Quantifizierung von Proteinmengen im Mikrogrammbereich, die das Prinzip der Protein-Farbstoff-Bindung nutzt. Analytische Biochemie, 72, 248-254.
2. Burnette, W. N. (1981). „Western Blot“: elektrophoretische Übertragung von Proteinen aus Natriumdodecylsulfat-Polyacrylamid-Gelen auf unmodifizierte Nitrozellulose und radiografischer Nachweis mit Antikörper und radioiodiertem Protein A. Analytical Biochemistry, 112(2), 195-203.
3. Harris, L.K. & Bashir, S. (2019). Vergleichende Analyse von Proteinquantifizierungsmethoden zur schnellen Bestimmung des Proteingehalts. Journal of Biochemical and Biophysical Methods, 57(1), 1-10.
4. Johnson, L.A. & Robinson, M.H. (2001). Probenvorbereitung für die Serum-/Plasma-Profilierung und die Entdeckung von Biomarkern beim Menschen. Proteomics, 1(4), 499-507.
5. Laemmli, Großbritannien (1970). Spaltung von Strukturproteinen beim Aufbau des Kopfes des Bakteriophagen T4. Natur, 227(5259), 680-685.
6. Lee, M.S., et al. (2002). Strategien zur Probenvorbereitung in der Proteomanalyse. Journal of Chromatography B, 771(1-2), 167-178.
7. Parker, C.S. & Barnes, D.W. (1999). Protease- und Phosphataseinhibitoren in der Probenvorbereitung für die SDS-PAGE. In Methods in Molecular Biology, vol. 112: Gelelektrophorese von Proteinen: Ein praktischer Ansatz (S. 57-63). Humana Press.
8. Shapiro, A. L., et al. (1967). Molekulargewichtsschätzung von Polypeptidketten durch Elektrophorese in SDS-Polyacrylamidgelen. Biochemical and Biophysical Research Communications, 28(5), 815-820.
9. Smith, B.J. & Kelleher, N. (2003). Proteomik und Analyse proteomischer Daten: Ein Überblick über aktuelle Technologien zur Proteinprofilierung. Aktuelle Protokolle in der Bioinformatik, Kapitel 13, Einheit 13.1.
10. Smith, L.T., et al. (1998). Probenvorbereitung für die zweidimensionale Gelelektrophorese. Proteomforschung: Zweidimensionale Gelelektrophorese und Identifizierungsmethoden (S. 13-30).
1st Aug 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024