Inflammasom-Aktivierungswege: Ein umfassender Überblick
Inflammasome sind komplexe intrazelluläre Strukturen, die eine zentrale Rolle bei der Immunantwort spielen, indem sie pathogene Mikroorganismen und sterile Stressoren erkennen. Ihre Aktivierung ist ein entscheidender Schritt im Abwehrsystem des Wirts und führt zur Reifung und Sekretion entzündungsfördernder Zytokine wie IL-1β und IL-18. Dieser Artikel bietet eine detaillierte Untersuchung der Mechanismen, die der Aktivierung von Inflammasomen zugrunde liegen
Das Inflammasom verstehen: Struktur und Funktion
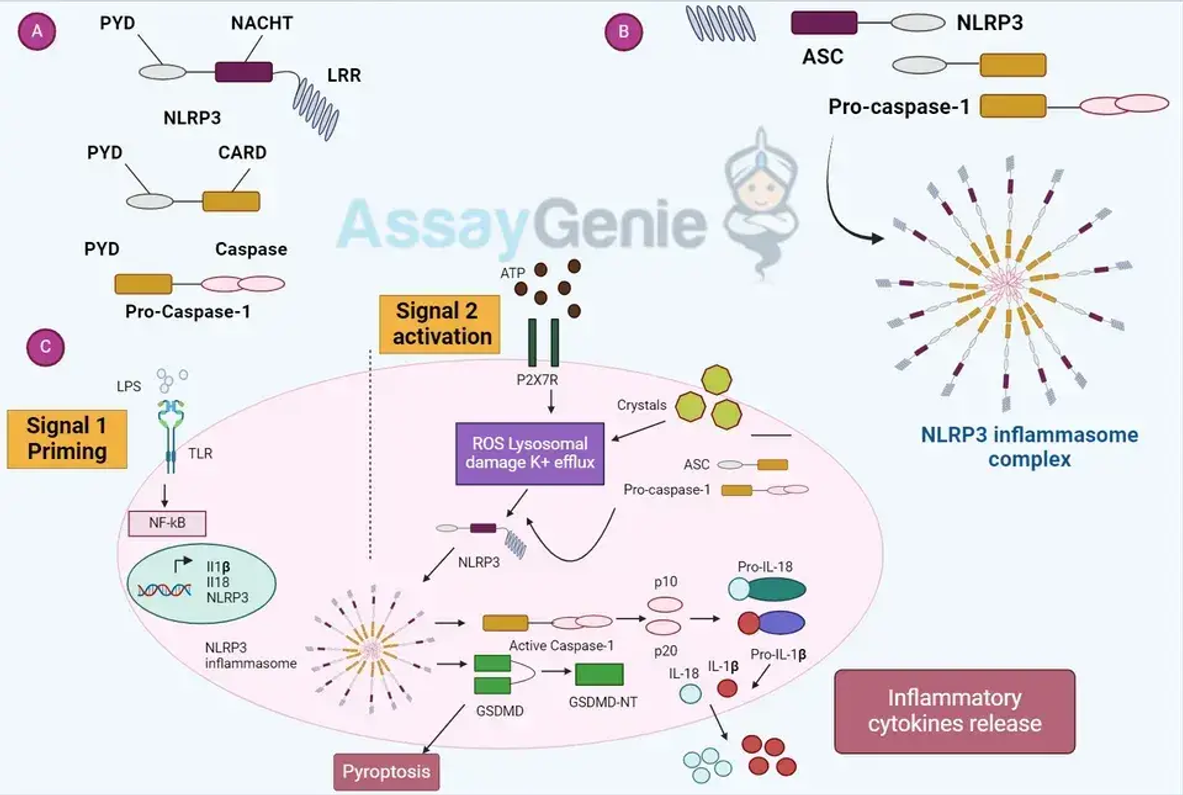
Inflammasome sind Multiprotein-Oligomere, die hauptsächlich aus einem Sensor (typischerweise einem Mustererkennungsrezeptor), dem Adapterprotein ASC und dem Effektorprotein Pro-Caspase-1 bestehen. Die am besten untersuchten Inflammasomen sind NLRP3, AIM2 und NLRC4, die jeweils unterschiedliche molekulare Muster und Reize erkennen.
NLRP3-Inflammasom-Aktivierung
Das NLRP3-Inflammasom reagiert auf eine Vielzahl von Signalen, darunter mikrobielle Toxine, ATP und kristalline Substanzen wie Harnsäure. Die Aktivierung erfolgt in zwei Schritten:
1. Priming: Beinhaltet die Aktivierung des NF-κB-Signalwegs, was zur Hochregulierung von NLRP3 und pro-IL-1β führt.
2. Aktivierung: Ausgelöst durch Kaliumausfluss, lysosomale Destabilisierung oder Produktion reaktiver Sauerstoffspezies (ROS), was zur NLRP3-Oligomerisierung, ASC-Rekrutierung und Caspase-1-Aktivierung führt.
AIM2-Inflammasom-Aktivierung
Das AIM2-Inflammasom (Absent in Melanoma 2) ist ein wichtiger Bestandteil des angeborenen Immunsystems und spielt eine zentrale Rolle bei der Erkennung und Reaktion auf zytosolische DNA. Inflammasome sind Multiproteinkomplexe, die als Sensoren für Zellstress oder -schäden dienen und Entzündungsreaktionen auslösen, um Krankheitserreger zu bekämpfen und die Gewebehomöostase aufrechtzuerhalten. Insbesondere AIM2 ist einer von mehreren Inflammasom-Sensoren, der sich durch seine Fähigkeit auszeichnet, doppelsträngige DNA (dsDNA) im Zytoplasma zu erkennen.
Die Aktivierung des AIM2-Inflammasoms erfolgt typischerweise als Reaktion auf intrazelluläre Krankheitserreger wie Viren, Bakterien oder Parasiten, die dsDNA in der Wirtszelle freisetzen oder erzeugen. Darüber hinaus können auch endogene Gefahrensignale, wie beschädigte Selbst-DNA von gestressten oder sterbenden Zellen, die AIM2-Aktivierung auslösen.
AIM2 erkennt doppelsträngige DNA im Zytosol, typischerweise von Viren oder Bakterien. Bei der DNA-Bindung erfährt AIM2 Konformationsänderungen, die die Rekrutierung von ASC und Pro-Caspase-1 erleichtern.
NLRC4-Inflammasom-Aktivierung
Das AIM2-Inflammasom (Absent in Melanoma 2) ist ein wichtiger Bestandteil des angeborenen Immunsystems und spielt eine zentrale Rolle bei der Erkennung und Reaktion auf zytosolische DNA. Inflammasome sind Multiproteinkomplexe, die als Sensoren für Zellstress oder -schäden dienen und Entzündungsreaktionen auslösen, um Krankheitserreger zu bekämpfen und die Gewebehomöostase aufrechtzuerhalten. Insbesondere AIM2 ist einer von mehreren Inflammasom-Sensoren, der sich durch seine Fähigkeit auszeichnet, doppelsträngige DNA (dsDNA) im Zytoplasma zu erkennen.
Die Aktivierung des AIM2-Inflammasoms erfolgt typischerweise als Reaktion auf intrazelluläre Krankheitserreger wie Viren, Bakterien oder Parasiten, die dsDNA in der Wirtszelle freisetzen oder erzeugen. Darüber hinaus können auch endogene Gefahrensignale, wie beschädigte Selbst-DNA von gestressten oder sterbenden Zellen, die AIM2-Aktivierung auslösen.
AIM2 erkennt doppelsträngige DNA im Zytosol, typischerweise von Viren oder Bakterien. Bei der DNA-Bindung erfährt AIM2 Konformationsänderungen, die die Rekrutierung von ASC und Pro-Caspase-1 erleichtern.
Regulatorische Mechanismen bei der Inflammasom-Aktivierung
Die Aktivität der Inflammasomen wird streng reguliert, um übermäßige Entzündungen zu verhindern. Autophagie, posttranslationale Modifikationen von Inflammasomkomponenten und die Freisetzung entzündungshemmender Zytokine sind wichtige Regulationsmechanismen.

Autophagie bei der Inflammasom-Regulation
Autophagie, ein zellulärer Abbauprozess, kann Inflammasomkomponenten abbauen und somit als negativer Regulator fungieren. Es entfernt beschädigte Organellen wie Mitochondrien, reduziert ROS und verhindert die Aktivierung von NLRP3.
Posttranslationale Modifikationen
Ubiquitinierung und Phosphorylierung von Inflammasomkomponenten modulieren deren Stabilität und Aktivität. Beispielsweise kann die Ubiquitinierung von NLRP3 dessen Oligomerisierung und Aktivierung verhindern.
Rolle entzündungshemmender Zytokine
Pathophysiologische Implikationen der Inflammasom-Aktivierung
Eine Dysregulation des Inflammasoms ist mit verschiedenen Krankheiten verbunden, darunter Autoimmunerkrankungen, metabolischen Syndromen und neurodegenerativen Erkrankungen. Das Verständnis dieser Wege bietet potenzielle therapeutische Ziele für die Behandlung dieser Erkrankungen.
Abschluss
Inflammasom-Aktivierungswege stellen ein komplexes Zusammenspiel molekularer Signale und Regulierungsmechanismen dar, die für die Aufrechterhaltung der Immunhomöostase von entscheidender Bedeutung sind. Das komplizierte Gleichgewicht zwischen Aktivierung und Regulierung unterstreicht die Bedeutung von Inflammasomen für Gesundheit und Krankheit.
Verweise
1. Vivier, E., Tomasello, E., Baratin, M., Walzer, T. & Ugolini, S. (2008). Funktionen natürlicher Killerzellen. Nature Immunology, 9(5), 503–510.
2. Nimmerjahn, F. & Ravetch, JV (2006). Fcγ-Rezeptoren als Regulatoren von Immunantworten. Nature Reviews Immunology, 8(1), 34–47.
3. Clynes, R. A., Towers, T. L., Presta, L. G. & Ravetch, J. V. (2000). Inhibitorische Fc-Rezeptoren modulieren die Zytotoxizität in vivo gegenüber Tumorzielen. Naturmedizin, 6(4), 443–446.
4. Hogarth, PM (2002). Fc-Rezeptoren sind wichtige Mediatoren antikörperbasierter Entzündungen bei Autoimmunerkrankungen. Current Opinion in Immunology, 14(6), 798–802.
5. Bruhns, P. (2012). Eigenschaften von Maus- und menschlichen IgG-Rezeptoren und ihr Beitrag zu Krankheitsmodellen. Blut, 119(24), 5640–5649.
6. Smith, K. G. & Clatworthy, M. R. (2010). FcγRIIB bei Autoimmunität und Infektion: evolutionäre und therapeutische Implikationen. Nature Reviews Immunology, 10(5), 328–343.
7. Weiner, L. M. & Surana, R. (2010). Monoklonale Antikörper: vielseitige Plattformen für die Krebsimmuntherapie. Nature Reviews Immunology, 10(5), 317–327.
2. Nimmerjahn, F. & Ravetch, JV (2006). Fcγ-Rezeptoren als Regulatoren von Immunantworten. Nature Reviews Immunology, 8(1), 34–47.
3. Clynes, R. A., Towers, T. L., Presta, L. G. & Ravetch, J. V. (2000). Inhibitorische Fc-Rezeptoren modulieren die Zytotoxizität in vivo gegenüber Tumorzielen. Naturmedizin, 6(4), 443–446.
4. Hogarth, PM (2002). Fc-Rezeptoren sind wichtige Mediatoren antikörperbasierter Entzündungen bei Autoimmunerkrankungen. Current Opinion in Immunology, 14(6), 798–802.
5. Bruhns, P. (2012). Eigenschaften von Maus- und menschlichen IgG-Rezeptoren und ihr Beitrag zu Krankheitsmodellen. Blut, 119(24), 5640–5649.
6. Smith, K. G. & Clatworthy, M. R. (2010). FcγRIIB bei Autoimmunität und Infektion: evolutionäre und therapeutische Implikationen. Nature Reviews Immunology, 10(5), 328–343.
7. Weiner, L. M. & Surana, R. (2010). Monoklonale Antikörper: vielseitige Plattformen für die Krebsimmuntherapie. Nature Reviews Immunology, 10(5), 317–327.
28th Jun 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024