Immunglobulin-Antikörper verstehen: Struktur, Funktion und Typen
Immunglobulin-Antikörper stehen an der Spitze des Immunabwehrsystems und bieten einen ausgeklügelten Mechanismus zur Erkennung und Neutralisierung einer Vielzahl von Krankheitserregern, darunter Bakterien, Viren und andere potenziell schädliche Fremdkörper. Diese Antikörper, auch Immunglobuline (Ig) genannt, werden von spezialisierten Zellen des Immunsystems produziert und dienen als entscheidender Bestandteil sowohl der angeborenen als auch der adaptiven Immunität. Dieser Artikel bietet ein tieferes Verständnis der Struktur, Funktion und Klassifizierung von Immunglobulin-Antikörpern und hebt ihre wesentliche Rolle bei der Erhaltung der Gesundheit und der Bekämpfung von Krankheiten hervor.
Detaillierte Struktur von Immunglobulin-Antikörpern
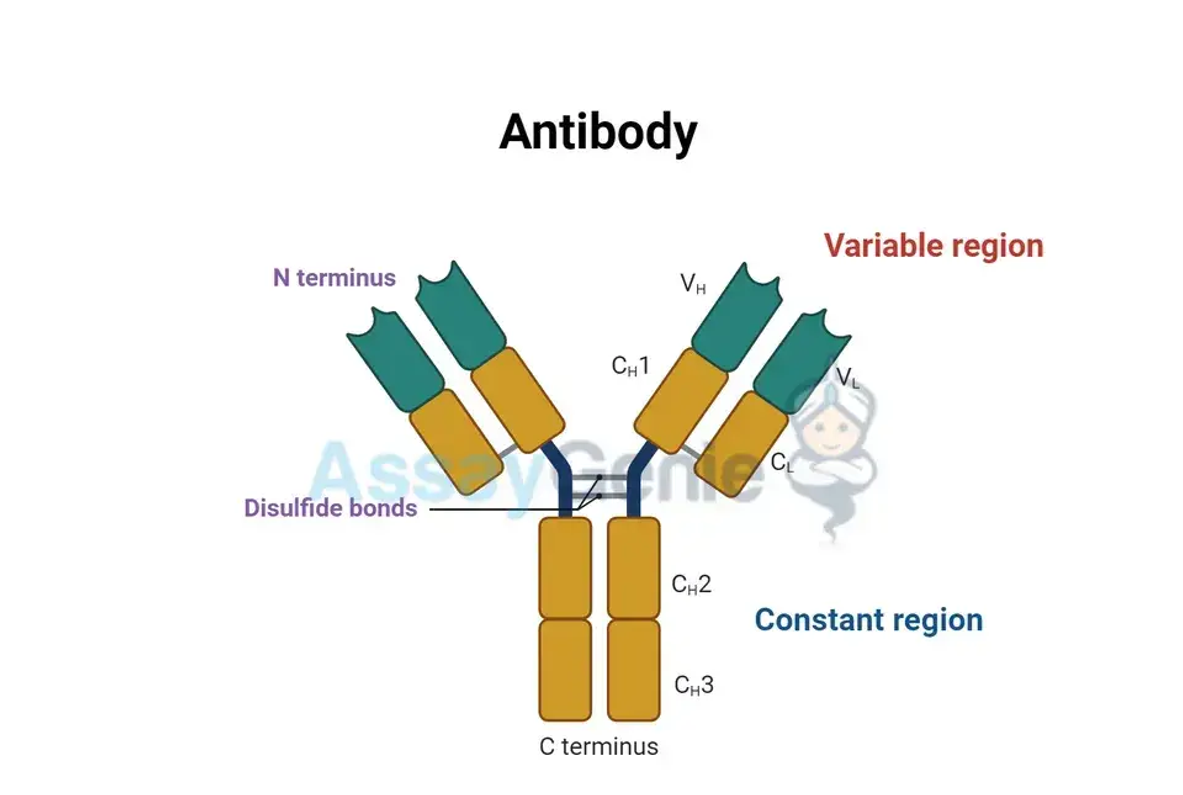
Auf molekularer Ebene sind Immunglobulin-Antikörper Y-förmige Moleküle, die aus vier Polypeptidketten bestehen: zwei identische schwere Ketten und zwei identische leichte Ketten, die durch Disulfidbrücken miteinander verbunden sind. Die Struktur eines Antikörpers kann weiter in zwei funktionelle Bereiche unterteilt werden:
1. Fab-Region (Antigen-bindendes Fragment)
Location of the Fab Region
Location of the Fab Region
Die Arme des Y-förmigen Moleküls
- Positionierung: Die Fab-Region stellt die oberen Teile der Y-förmigen Struktur des Antikörpers dar und erstreckt sich nach außen, um die Interaktion mit Antigenen zu ermöglichen.
- Zusammensetzung: Jeder Arm des Antikörpers enthält eine Fab-Region, die weiter unterteilt ist in eine variable (V) Region an der Spitze und eine konstante (C) Region näher am Rumpf des Antikörpers.
Funktion der Fab-Region
Zu den Funktionen der Fab-Region (Fragment, Antigenbindung) eines Immunglobulin-Antikörpers gehören:
Antigenerkennung: Identifiziert und bindet gezielt Antigene.
Hohe Spezifität: Aufgrund seiner variablen (V) Domäne kann es eine Vielzahl von Antigenen mit hoher Spezifität erkennen.
Neutralisierung: Verhindert, dass Krankheitserreger Zellen infizieren, indem sie sich an sie binden.
Vielfalt: Ermöglicht dem Immunsystem, auf eine Vielzahl von Krankheitserregern zu reagieren.
2. Fc-Region (kristallisierbares Fragment)
Die Fc-Region (Fragment, kristallisierbar), die für die Funktionalität und Spezifität von Immunglobulin-Antikörpern von entscheidender Bedeutung ist, dient als Rückgrat für die vielfältigen Rollen, die Antikörper im Immunsystem spielen. Hier ist eine erweiterte Übersicht über seinen Standort und seine Funktion:
Location of the Fc Region
Location of the Fc Region
- Stamm der Y-Form: Die Fc-Region bildet die Basis oder den Stamm der Y-förmigen Struktur des Antikörpers. Im Gegensatz zu den variablen Fab-Regionen, die Antigene binden, bleibt die Fc-Region innerhalb jeder Antikörperklasse konstant und stellt ein stabiles Gerüst bereit, das Interaktionen mit anderen Immunkomponenten vermittelt.
Funktion der Fc-Region
- Aktivierung von Immunzellen: Es bindet an Fc-Rezeptoren auf Immunzellen und löst so Phagozytose und antikörperabhängige zelluläre Zytotoxizität (ADCC) aus.
- Komplementaktivierung: Initiiert das Komplementsystem, was zur Lyse oder Opsonisierung des Krankheitserregers und damit zur verstärkten Phagozytose führt.
- Regulierung der Antikörperhalbwertszeit: Beeinflusst die Serumhalbwertszeit von Antikörpern und beeinflusst so die Dauer des Immunschutzes.

Vielfältige Funktionen von Immunglobulin-Antikörpern
Immunglobulin-Antikörper steuern eine Reihe von Immunreaktionen, um den Körper vor Krankheitserregern zu schützen:
Neutralisierung: Durch die Bindung an bestimmte Stellen von Krankheitserregern oder Toxinen können Antikörper deren schädliche Wirkung blockieren.
Opsonisierung: Antikörper umhüllen Krankheitserreger und machen sie zu einem attraktiveren Ziel für Phagozyten, die sie verschlingen und zerstören.
Aktivierung des Komplementsystems: Die Fc-Region bestimmter Antikörper kann die Komplementkaskade initiieren, was zur Lyse oder Opsonisierung des Krankheitserregers führt.
Immobilisierung und Verhinderung der Anhaftung von Krankheitserregern: Durch die Bindung an bakterielle Flagellen oder Pili können Mikroben immobilisiert und daran gehindert werden, sich an Wirtszellen anzuheften.
Vernetzung (Agglutination): Antikörper können an Antigene auf der Oberfläche von Krankheitserregern binden, diese miteinander verbinden und ihre Entfernung durch Phagozyten erleichtern.
Antikörperabhängige zelluläre Zytotoxizität (ADCC): Antikörper können Zellen gezielt zur Zerstörung durch natürliche Killerzellen (NK) angreifen.
Umfassende Klassifizierung von Immunglobulin-Antikörpern
Immunglobulin-Antikörper werden in fünf Hauptklassen eingeteilt, jede mit unterschiedlichen strukturellen und funktionellen Merkmalen:
1. IgG
1. IgG
- Merkmale: IgG-Antikörper kommen im Kreislaufsystem am häufigsten vor und bieten aufgrund ihrer Fähigkeit, die Plazenta zu passieren und dem Fötus eine passive Immunität zu bieten, einen langfristigen Schutz.
- Unterklassen: IgG wird weiter in vier Unterklassen (IgG1, IgG2, IgG3 und IgG4) unterteilt, basierend auf der Variabilität ihrer schweren Ketten, die ihre funktionellen Eigenschaften beeinflusst.

2. IgM
2. IgM
- Merkmale: IgM ist der erste Antikörper, der als Reaktion auf ein Antigen produziert wird und hauptsächlich im Blut und in der Lymphflüssigkeit vorkommt. Seine pentamere Struktur ermöglicht eine wirksame Agglutination und Komplementaktivierung.
3. IgA
3. IgA
- Merkmale: IgA-Antikörper kommen überwiegend in Schleimhautbereichen wie dem Verdauungstrakt und den Atemwegen vor und spielen eine entscheidende Rolle bei der Schleimhautimmunität. Sie kommen in zwei Formen vor: Serum-IgA (monomer) und sekretorisches IgA (dimer).
4. IgE
4. IgE
- Merkmale: IgE-Antikörper sind an allergischen Reaktionen und dem Schutz vor parasitären Infektionen beteiligt. Sie binden an Mastzellen und Basophile und lösen so die Freisetzung von Histamin und anderen Mediatoren aus.
5. IgD
5. IgD

Tabelle 1: Merkmale der Immunglobulinklassen
Class | Heavy Chain | Location | Function |
IgG | γ | Blut, extrazelluläre Flüssigkeit | Neutralisiert Krankheitserreger, Opsonisierung, Komplementaktivierung |
IgM | μ | B-Zelloberfläche, Plasma | Primäre Reaktion auf eine Infektion, Komplementaktivierung |
IgA | α | Schleimhautbereiche, Sekrete | Barriereschutz, Neutralisierung |
IgE | ε | An Mastzellen und Basophile gebunden | Allergische Reaktionen, antiparasitäre Abwehr |
IgD | δ | B-Zelloberfläche | B-Zell-Rezeptor |
Abschluss
Die komplexe Welt der Immunglobulin-Antikörper zeigt die bemerkenswerte Anpassungsfähigkeit und Präzision des Immunsystems. Durch ihre vielfältigen Strukturen und Funktionen bieten diese Antikörper nicht nur eine sofortige Abwehr von Krankheitserregern, sondern spielen auch eine entscheidende Rolle im Langzeitgedächtnis des Immunsystems und sorgen für schnellere und wirksamere Reaktionen bei späteren Kontakten mit denselben Antigenen. Das Verständnis der Komplexität von Immunglobulin-Antikörpern ist für die Weiterentwicklung der immunologischen Forschung, der Impfstoffentwicklung und therapeutischer Interventionen gegen verschiedene Krankheiten von entscheidender Bedeutung.
Verweise
- Janeway, C. A., Travers, P., Walport, M. und Shlomchik, M. J. (2016). Immunbiologie: Das Immunsystem in Gesundheit und Krankheit. 9. Aufl. New York: Garland Science.
- Murphy, K., Weaver, C. (2017). Janeways Immunbiologie. 9. Aufl. New York: Garland Science.
- Abbas, A.K., Lichtman, A.H. & Pillai, S. (2020). Zelluläre und molekulare Immunologie. 10. Aufl. Philadelphia: Elsevier.
- Alberts, B., Johnson, A., Lewis, J., Raff, M., Roberts, K. & Walter, P. (2014). Molekularbiologie der Zelle. 6. Aufl. New York: Garland Science.
- Schroeder, H.W. & Cavacini, L. (2010). Struktur und Funktion von Immunglobulinen. Journal of Allergy and Clinical Immunology, 125(2 Suppl 2), S41-S52.
- Vidarsson, G., Dekkers, G. & Rispens, T. (2014). IgG-Unterklassen und Allotypen: von der Struktur bis zu Effektorfunktionen. Frontiers in Immunology, 5, 520.
- Woof, J.M. & Burton, D.R. (2004). Menschliche Antikörper-Fc-Rezeptor-Wechselwirkungen beleuchtet durch Kristallstrukturen. Nature Reviews Immunology, 4(2), 89-99.
- Nimmerjahn, F. & Ravetch, J.V. (2008). Fcγ-Rezeptoren als Regulatoren von Immunantworten. Nature Reviews Immunology, 8(1), 34-47.
2nd Jul 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024