Fluoreszenzresonanzenergietransfer-Assays (FRET): Ein Einblick in molekulare Wechselwirkungen
FRET verstehen: Die Grundlagen

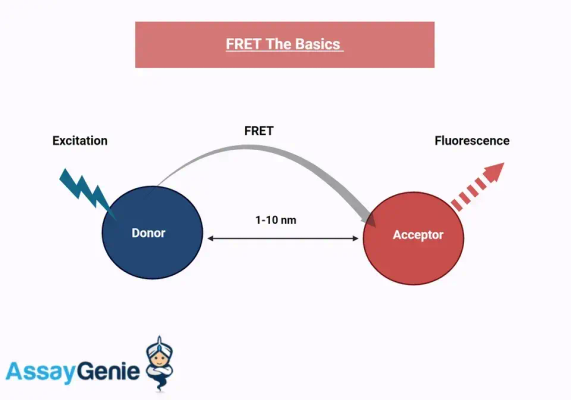
Abbildung: FRET-Grundlagen
Schlüsselkomponenten von FRET-Assays
Zu den Kernkomponenten von FRET-Assays gehören die Donor- und Akzeptor-Fluorophore. Die Effizienz von FRET hängt von mehreren Faktoren ab, wie etwa der spektralen Überlappung zwischen der Donor-Emission und der Akzeptor-Absorption, dem Abstand zwischen den Fluorophoren und ihrer relativen Ausrichtung. Die Optimierung dieser Faktoren ist für die erfolgreiche Anwendung von FRET-Assays in der biologischen Forschung von entscheidender Bedeutung.
Anwendungen von FRET-Assays in der wissenschaftlichen Forschung
FRET-Assays haben in verschiedenen Forschungsbereichen breite Anwendung gefunden. Sie sind maßgeblich an der Untersuchung von Protein-Protein-Interaktionen, der Überwachung intrazellulärer Signalwege und dem Verständnis der Mechanismen der Enzymaktivitäten beteiligt. Darüber hinaus werden FRET-basierte Techniken zur Untersuchung von Nukleinsäurestrukturen und -dynamiken eingesetzt und bieten wertvolle Einblicke in Genexpressions- und Regulationsprozesse.
- Protein-Protein-Wechselwirkungen
Eine der Hauptanwendungen von FRET-Assays ist die Untersuchung von Protein-Protein-Wechselwirkungen. Durch die Markierung interagierender Proteine mit geeigneten Donor- und Akzeptor-Fluorophoren können Forscher die Dynamik dieser Interaktionen in Echtzeit überwachen und so wichtige Informationen über zelluläre Signalwege und Krankheitsmechanismen liefern.
- Nukleinsäurestudien
FRET-Assays spielen auch eine wichtige Rolle bei der Untersuchung der Struktur und Dynamik von Nukleinsäuren. Sie dienen der Untersuchung von DNA-Replikations-, Transkriptions- und RNA-Faltungsprozessen und geben Aufschluss über die grundlegenden Aspekte der genetischen Regulation und Expression.

Abbildung: Nachweis von Protein-Protein-Interaktionen mittels FRET
Fortschritte und zukünftige Richtungen
Abschluss
Verweise
1. Förster, T. (1948). „Intermolekulare Energiemigration und Fluoreszenz.“ Annals of Physics, 2(1-2), 55-75.
2. Wu, P. & Brand, L. (1994). „Resonanzenergieübertragung: Methoden und Anwendungen.“ Analytische Biochemie, 218(1), 1-13.
3. Jares-Erijman, E. A. & Jovin, T. M. (2003). „FRET-Bildgebung.“ Nature Biotechnology, 21(11), 1387-1395.
4. Koushik, S. V. & Vogel, S. S. (2008). „Energietransfer-sensibilisierte Fluoreszenz von Biopolymeren.“ Chemical Reviews, 108(12), 5497-5518.
5. Roy, R., Hohng, S. & Ha, T. (2008). „Ein praktischer Leitfaden zum Einzelmolekül-FRET.“ Nature Methods, 5(6), 507-516.
6. Stryer, L. & Haugland, R. P. (1967). „Energieübertragung: ein spektroskopisches Lineal.“ Proceedings of the National Academy of Sciences, 58(2), 719-726.
7. Lakowicz, JR (2006). Prinzipien der Fluoreszenzspektroskopie. 3. Aufl. Springer.
8. Tsien, R. Y. (1998). „Das grün fluoreszierende Protein.“ Annual Review of Biochemistry, 67, 509-544.
9. Piston, D. W. & Kremers, G. J. (2007). „Fluoreszierendes Protein FRET: das Gute, das Schlechte und das Hässliche.“ Trends in Biochemical Sciences, 32(9), 407-414.
16th Jul 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024