Erschließung der zellulären Anpassung: Der HIF-Enhancer-Signalweg und seine Auswirkungen auf die Hypoxie-Reaktion
Hypoxie oder niedrige Sauerstoffwerte stellen eine erhebliche Herausforderung für Zellen dar und erfordern schnelle und effiziente Anpassungsmechanismen. Der Hypoxia-Inducible Factor (HIF)-Weg ist ein bekannter Regulator zellulärer Reaktionen auf Hypoxie und steuert die Expression von Genen, die an Angiogenese, Erythropoese und Glykolyse beteiligt sind. Es spielt eine entscheidende Rolle bei der zellulären Anpassung an Bedingungen mit niedrigem Sauerstoffgehalt und sichert das Überleben und die Homöostase in verschiedenen physiologischen und pathologischen Situationen. Jüngste Studien haben eine zusätzliche Komplexitätsebene bei der HIF-Regulation aufgedeckt, den sogenannten HIF-Enhancer-Weg. In diesem Artikel werden die Mechanismen, die Regulierung und die Bedeutung des HIF-Enhancer-Signalwegs bei zellulären Reaktionen auf Hypoxie untersucht.
Mechanismen des HIF-Enhancer-Signalwegs:
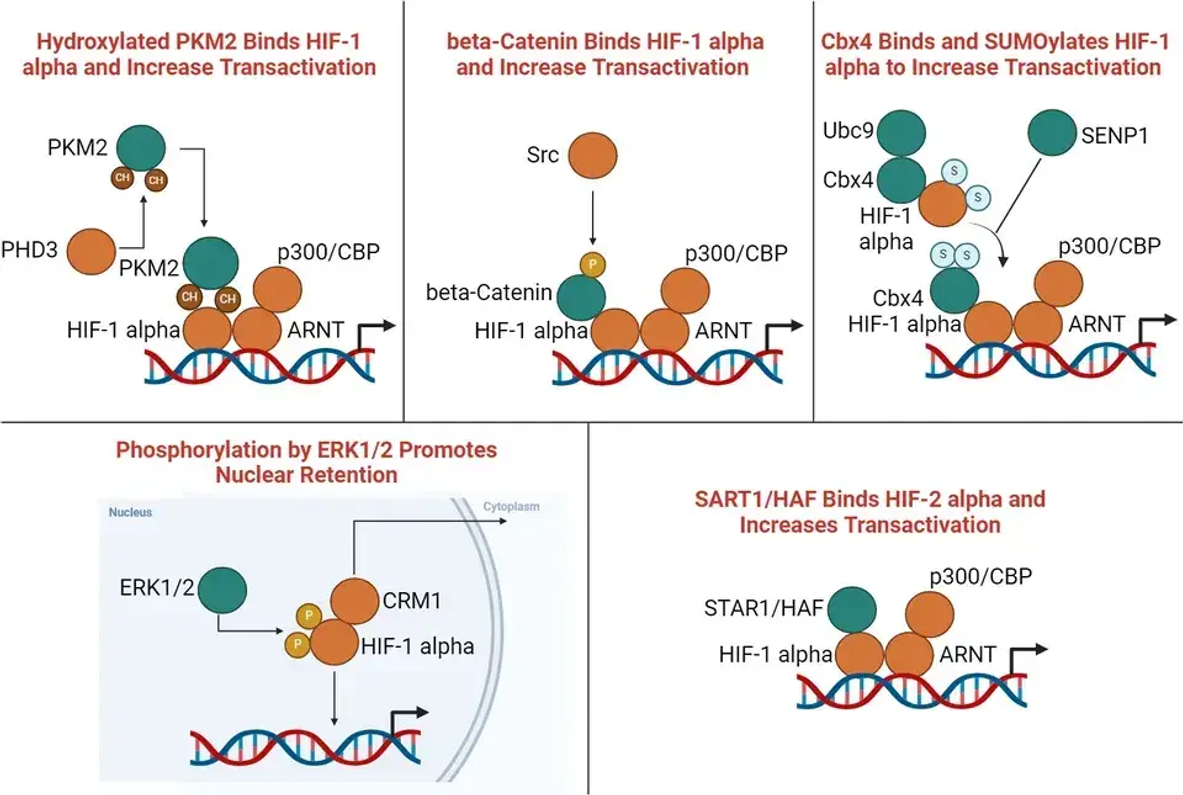
Der HIF-Enhancer-Signalweg beruht auf einer Reihe molekularer Ereignisse, die die HIF-Reaktion unter hypoxischen Bedingungen verstärken. Ein wichtiger Akteur auf diesem Weg ist die HIF-Prolylhydroxylase (PHD), die traditionell als negativer Regulator von HIF fungiert, indem sie dessen Abbau bei Normoxie anstrebt. Unter hypoxischen Bedingungen wird jedoch der HIF-Enhancer-Weg aktiviert, was zu einer erhöhten Stabilität und Aktivität von HIF führt.
Die erhöhte Stabilität von HIF bei Hypoxie wird auf die Hemmung der PHD-Aktivität durch Faktoren wie reaktive Sauerstoffspezies (ROS) und Stoffwechselzwischenprodukte zurückgeführt. Darüber hinaus haben aktuelle Studien neue Proteine identifiziert, die direkt mit HIF interagieren und es so vor dem Abbau schützen. Diese Wechselwirkungen tragen zur längeren Präsenz von aktivem HIF im Zellkern bei und fördern die Transkription nachgeschalteter Zielgene.

Mechanismus des HIF-Enhancer-Signalwegs unter hypoxischen Bedingungen
Regulierung des HIF-Enhancer-Signalwegs:
Der HIF-Enhancer-Signalweg ist streng reguliert, um eine ausgewogene zelluläre Reaktion auf Hypoxie sicherzustellen. Mehrere Signalwege laufen zusammen, um die Aktivität wichtiger Komponenten dieses Weges zu modulieren. Beispielsweise wurde gezeigt, dass der Phosphatidylinositol-3-Kinase (PI3K)/Akt-Signalweg, der für seine Beteiligung am Zellüberleben bekannt ist, den HIF-Enhancer-Signalweg unter hypoxischen Bedingungen aktiviert. Darüber hinaus können durch Hypoxie verursachte Veränderungen im Zellstoffwechsel, einschließlich Veränderungen in den Zwischenprodukten des Tricarbonsäurezyklus (TCA), den HIF-Enhancer-Weg beeinflussen.
Epigenetische Modifikationen spielen auch eine entscheidende Rolle bei der Regulierung des HIF-Enhancer-Signalwegs. Jüngste Studien haben gezeigt, dass Histonacetylierung und DNA-Methylierung an bestimmten Orten die Zugänglichkeit von Enhancern modulieren können, die mit HIF-Zielgenen assoziiert sind. Diese Ergebnisse verdeutlichen das komplexe Zusammenspiel genetischer und epigenetischer Mechanismen bei der Feinabstimmung des HIF-Enhancer-Signalwegs.
Bedeutung des HIF Enhancer Pathway:
Das Verständnis des HIF-Enhancer-Signalwegs hat weitreichende Auswirkungen auf verschiedene Bereiche, darunter die Krebsbiologie, die Herz-Kreislauf-Forschung und die regenerative Medizin. Bei Krebs beispielsweise ist die Fehlregulation des HIF-Signalwegs ein Kennzeichen der Tumorprogression. Die Identifizierung des HIF-Enhancer-Signalwegs bietet neue therapeutische Ansatzpunkte für Interventionen, die darauf abzielen, das empfindliche Gleichgewicht zu stören, das das Überleben von Krebszellen in hypoxischen Mikroumgebungen aufrechterhält.
In der kardiovaskulären Forschung wurde der HIF-Enhancer-Weg mit der ischämischen Vorkonditionierung in Verbindung gebracht, einem Phänomen, bei dem kurze Episoden von Hypoxie die Zellen vor nachfolgenden schweren hypoxischen Angriffen schützen. Die Aufklärung der Feinheiten des HIF-Enhancer-Signalwegs könnte neue Strategien zur Nutzung des therapeutischen Potenzials der ischämischen Vorkonditionierung bei Herz-Kreislauf-Erkrankungen aufzeigen.
Implikationen für zukünftige Therapien
Der HIF-Enhancer-Weg stellt eine neue Grenze im Verständnis der zellulären Reaktionen auf Hypoxie dar. Sein komplexes regulatorisches Netzwerk und die Interaktion mit verschiedenen zellulären Prozessen unterstreichen seine Bedeutung für die Aufrechterhaltung der zellulären Homöostase unter schwierigen Bedingungen. Mit fortschreitender Forschung auf diesem Gebiet sind die Identifizierung spezifischer molekularer Akteure und die Entwicklung gezielter Interventionen vielversprechend, um Therapiestrategien bei mit Hypoxie verbundenen Krankheiten voranzutreiben und letztendlich die Behandlungsergebnisse für die Patienten zu verbessern.
Referenzen:
1. Semenza, G. L. (2012). Hypoxie-induzierbare Faktoren: Mediatoren der Krebsprogression und Ziele für die Krebstherapie. Trends in den pharmakologischen Wissenschaften, 33(4), 207-214.
2. Majmundar, A. J., Wong, W. J. und Simon, M. C. (2010). Hypoxie-induzierbare Faktoren und die Reaktion auf hypoxischen Stress. Molekulare Zelle, 40(2), 294-309.
3. Kaelin Jr, W. G. & Ratcliffe, P. J. (2008). Sauerstoffwahrnehmung durch Metazoen: die zentrale Rolle des HIF-Hydroxylase-Signalwegs. Molekulare Zelle, 30(4), 393-402.
4. Lee, K. E. & Simon, M. C. (2015). Von Stammzellen zu Krebsstammzellen: HIF betritt die Bühne. Aktuelle Meinung in der Zellbiologie, 37, 24-29.
5. Wenger, R. H. & Stiehl, D. P. (2011). Camenisch G. Integration der Sauerstoffsignalisierung beim Konsens-HRE. Science's STKE, 2005(306), re12.
6. Schofield, C. J. & Ratcliffe, P. J. (2004). Sauerstofferkennung durch HIF-Hydroxylasen. Naturrezensionen. Molekulare Zellbiologie, 5(5), 343-354.
7. Taylor, C. T. (2008). Mitochondrien und zelluläre Sauerstofferkennung im HIF-Signalweg. Biochemical Journal, 409(1), 19-26.
8. Batie, M., Frost, J., Frost, M., Wilson, J. W., Schofield, P. & Rocha, S. (2019). Hypoxie führt zu schnellen Veränderungen der Histonmethylierung und programmiert das Chromatin neu. Science, 363(6432), 1222-1226.
23rd Aug 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024