Differenzierungswege mesenchymaler Stammzellen: Abstammungsspezifische Marker entschlüsseln
Der komplizierte Prozess der Differenzierung mesenchymaler Stammzellen (MSC) ist ein Eckpfeiler der Entwicklungsbiologie und der regenerativen Medizin. Mesenchymale Stammzellen, die für ihre Fähigkeit zur Selbsterneuerung und Multipotenz bekannt sind, können sich in verschiedene Zelltypen differenzieren und so wesentlich zur Gewebereparatur und Homöostase beitragen. Dieser Artikel befasst sich mit den Differenzierungswegen von MSCs und konzentriert sich dabei auf linienspezifische Marker, die für die Identifizierung und das Verständnis dieser Wege von entscheidender Bedeutung sind.
Mesenchymale Stammzellen verstehen:
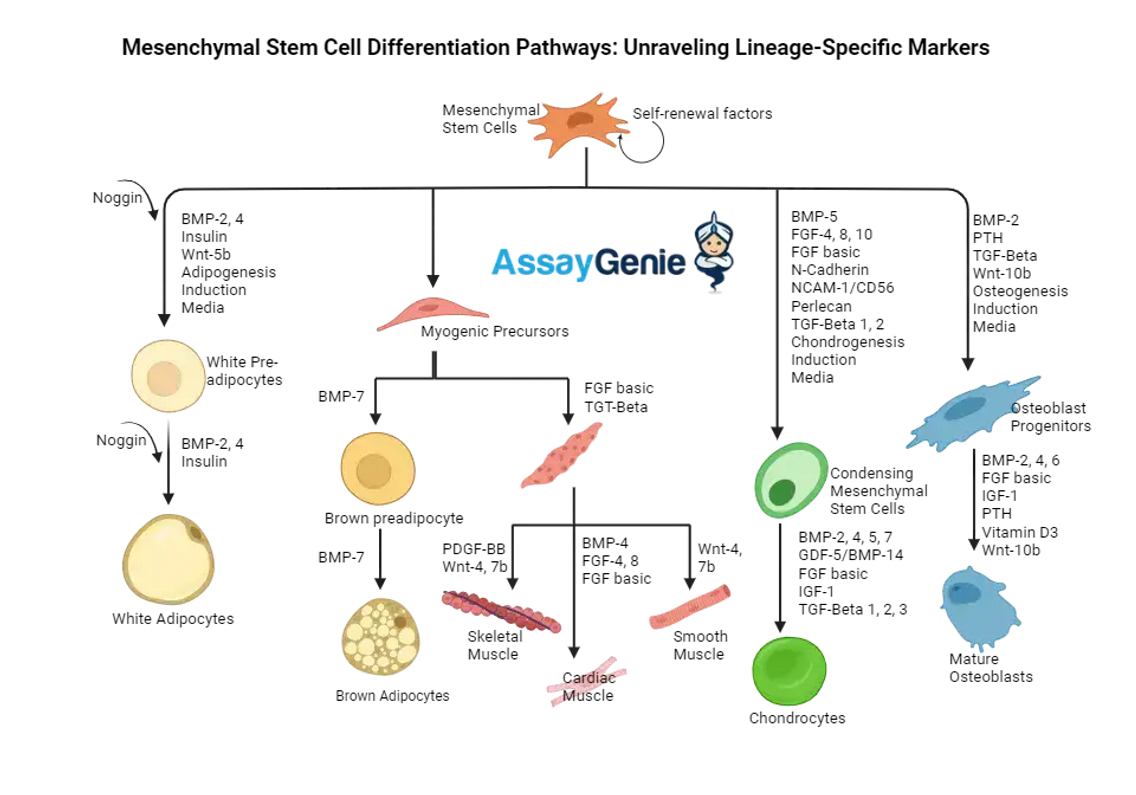
Osteogener Differenzierungsweg:
Die osteogene Differenzierung ist einer der Schlüsselwege von MSCs, wo sie sich in knochenbildende Osteoblasten umwandeln. Diese Differenzierung ist durch die Expression spezifischer Marker wie Runt-bezogener Transkriptionsfaktor 2 (RUNX2), alkalische Phosphatase (ALP), Osteopontin (OPN) und Osteocalcin (OCN) gekennzeichnet. RUNX2 wird oft als Hauptregulator bei der Differenzierung von Osteoblasten angesehen, da es die Transkription anderer osteoblastenspezifischer Gene initiiert.
Chondrogener Differenzierungsweg:
Auf dem chondrogenen Weg differenzieren sich MSCs zu Chondrozyten, den Zellen, die für die Bildung von Knorpelgewebe verantwortlich sind. Zu den wichtigsten Markern auf diesem Weg gehören SRY (geschlechtsbestimmende Region Y)-Box 9 (SOX9), Kollagen Typ II und Aggrecan. SOX9 spielt eine entscheidende Rolle in den frühen Stadien der Chondrogenese und reguliert die Expression von Kollagen Typ II und Aggrecan, die wesentliche Bestandteile der Knorpelmatrix sind.
Adipogener Differenzierungsweg:
Die adipogene Differenzierung führt zur Bildung von Adipozyten oder Fettzellen. Dieser Prozess wird durch die Expression von Markern wie Peroxisome Proliferator-Activated Receptor Gamma (PPARγ), CCAAT/Enhancer-Binding Protein Alpha (C/EBPα) und Adiponektin identifiziert. PPARγ ist ein wichtiger Transkriptionsfaktor, der die Expression von Genen steuert, die an der Reifung von Adipozyten und der Lipidakkumulation beteiligt sind.
Abstammungsspezifische Marker: Werkzeuge zur Identifizierung und Forschung
Die Identifizierung linienspezifischer Marker ist für die Untersuchung der MSC-Differenzierung von entscheidender Bedeutung. Diese Marker liefern nicht nur Einblicke in die molekularen Mechanismen, die die MSC-Differenzierung steuern, sondern dienen auch als wertvolle Werkzeuge in der regenerativen Medizin und ermöglichen die gezielte Differenzierung von MSCs in gewünschte Zelltypen für therapeutische Zwecke.
Herausforderungen und Zukunftsperspektiven:
Obwohl beim Verständnis der MSC-Differenzierungswege erhebliche Fortschritte erzielt wurden, bleiben Herausforderungen bestehen. Ein zentrales Problem ist die Heterogenität der MSC-Populationen, die zu einer Variabilität des Differenzierungspotenzials führen kann. Darüber hinaus spielen die Mikroumgebung und extrinsische Faktoren eine wichtige Rolle bei der Steuerung des Schicksals von MSC, sodass weitere Forschung erforderlich ist, um ihr therapeutisches Potenzial voll auszuschöpfen.
Abschluss:
Die Untersuchung der Differenzierung mesenchymaler Stammzellen und die Identifizierung linienspezifischer Marker sind von entscheidender Bedeutung für die Weiterentwicklung unseres Verständnisses der Zellbiologie und Geweberegeneration. Während die Forschung weiterhin die Komplexität der MSC-Differenzierungswege entschlüsselt, wird das Potenzial für innovative therapeutische Anwendungen in der regenerativen Medizin immer vielversprechender.
Referenzen
1. Pittenger, M.F., et al. (1999) Multilineage Potential of Adult Human Mesenchymal Stem Cells, Science, 284(5411), S. 143-147.
2. Bianco, P., et al. (2001) Stammzellen im Tissue Engineering, Nature, 414(6859), S. 118–121.
3. James, A.W. (2013) Review of Signaling Pathways Governing MSC Osteoogenic and Adipogenic Differentiation, Scientifica, 2013, S. 1-17.
4. Huang, G.T.J., et al. (2009) Mesenchymale Stammzellen aus Zahngewebe vs. solche aus anderen Quellen: Ihre Biologie und Rolle in der regenerativen Medizin, Journal of Dental Research, 88(9), S. 792-806.
5. Zuk, P.A., et al. (2001) Human Adipose Tissue Is a Source of Multipotent Stem Cells, Molecular Biology of the Cell, 13(12), S. 4279-4295.
6. Barry, F., et al. (2004) Mesenchymale Stammzelltherapie bei Gelenkerkrankungen, Nature Reviews Rheumatology, 4(10), S. 713-721.
7. Caplan, A.I. (2007) Adult Mesenchymal Stem Cells for Tissue Engineering Versus Regenerative Medicine, Journal of Cellular Physiology, 213(2), S. 341-347.
8. Sethe, S., et al. (2006) Mesenchymale Stammzellen: Können sie in der Therapie eingesetzt werden?, Stem Cells, 24(3), S. 575-579.
10th Aug 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024