Differenzierung angeborener lymphoider Zellen: Wächter der Immunhomöostase
Angeborene Lymphoidzellen (ILCs) stellen einen faszinierenden Bestandteil des Immunsystems dar und spielen eine entscheidende Rolle bei der Aufrechterhaltung der Gewebehomöostase und der Auslösung schneller Reaktionen gegen Krankheitserreger. Diesen Zellen fehlen antigenspezifische Rezeptoren, was sie von ihren adaptiven Gegenstücken unterscheidet. Ihre Fähigkeit, schnell auf Umweltreize zu reagieren, ist jedoch für eine wirksame Immunüberwachung von entscheidender Bedeutung. Einer der Schlüsselaspekte der Funktionalität von ILCs liegt in ihrem Differenzierungsprozess, einer komplexen Abfolge von Ereignissen, die diese Zellen in unterschiedliche Teilmengen mit speziellen Funktionen formen.
ILC-Differenzierung verstehen:
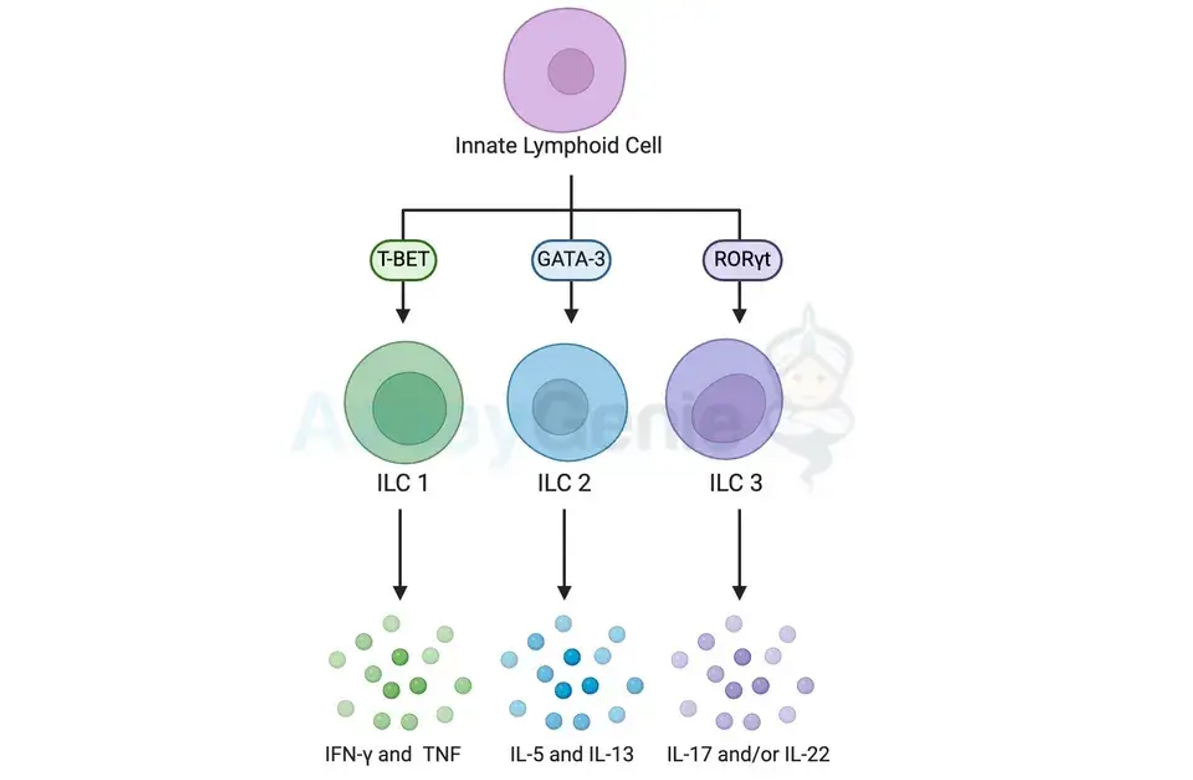
ILCs werden basierend auf ihren Zytokin sekretionsprofilen und ihrer Transkriptionsfaktor expression grob in drei Hauptuntergruppen eingeteilt: ILC1s, ILC2s und ILC3s. Jede Untergruppe ist darauf zugeschnitten, auf bestimmte Arten von Krankheitserregern zu reagieren und zu gewebespezifischen Immunantworten beizutragen. Die Differenzierung von ILCs ist ein fein abgestimmter Prozess, der durch verschiedene Signalwege, Transkriptionsfaktoren und Hinweise aus der Mikroumgebung gesteuert wird.
ILC1-Differenzierung:
ILC1s erinnern an klassische T-Helfer-1-Zellen (Th1), da sie Interferon-Gamma (IFN-γ) und Tumornekrosefaktor (TNF) produzieren. Ihre Differenzierung wird vor allem durch die Aktivierung des Transkriptionsfaktors T-bet beeinflusst. Dieser Prozess wird durch Interleukin-12 (IL-12) und IL-15-Signale initiiert, die T-bet aktivieren und ILC1s auf ihre Effektorfunktionen vorbereiten. ILC1 spielen eine entscheidende Rolle bei der Abwehr intrazellulärer Krankheitserreger wie Viren und tragen zu den frühen Stadien der Immunantwort bei.
ILC2-Differenzierung:
Im Gegensatz zu ILC1 zeichnen sich ILC2 durch ihre Fähigkeit aus, Typ-2-Zytokine zu produzieren, darunter Interleukin-5 (IL-5) und Interleukin-13 (IL-13). Das GATA-bindende Protein 3 (GATA-3) ist der Hauptregulator der ILC2-Differenzierung. Der Prozess wird durch Zytokine wie IL-33, IL-25 und Thymus-Stroma-Lymphopoietin (TSLP) initiiert, die GATA-3 aktivieren. ILC2 sind insbesondere an Reaktionen gegen Helminthenparasiten beteiligt und tragen zu allergischen Reaktionen bei.
ILC3-Differenzierung:
ILC3s, die mit der Produktion von IL-17 und/oder IL-22 verbunden sind, sind entscheidend für die Verteidigung von Schleimhautoberflächen, insbesondere im Darm. Der Retinsäurerezeptor-verwandte Orphan-Rezeptor Gamma t (RORγt) ist der Schlüsseltranskriptionsfaktor, der die ILC3-Differenzierung steuert. Signale von Zytokinen wie IL-23 und IL-1β aktivieren RORγt und lenken ILC-Vorläufer in Richtung des Schicksals von ILC3. ILC3 spielen eine entscheidende Rolle bei der Aufrechterhaltung der Darmhomöostase, der Abwehr bakterieller Infektionen und der Förderung der Gewebereparatur.
Gemeinsame Entwicklungspfade:
Während die Untergruppen der ILCs unterschiedliche Funktionen haben, weisen ihre Entwicklungspfade gemeinsame Elemente auf. Alle ILCs entstehen aus einem gemeinsamen lymphoiden Vorläufer (CLP) im Knochenmark. Diese Vorläufer wandern dann in periphere Gewebe und unterliegen einer weiteren Differenzierung, die durch lokale Mikroumgebungen beeinflusst wird.
Mikroumgebungshinweise bei der ILC-Differenzierung:
Die gewebespezifische Mikroumgebung spielt eine entscheidende Rolle bei der Gestaltung der ILC-Differenzierung. Stromazellen, Epithelzellen und andere Immunzellen tragen zur Freisetzung von Zytokinen und anderen Signalmolekülen bei, die die ILC-Entwicklung steuern. Beispielsweise ist die Mikroumgebung des Darms reich an IL-23 und IL-1β, was die Differenzierung von ILC3 fördert, die für die Aufrechterhaltung der Darmhomöostase unerlässlich sind.
Rolle der Notch-Signalisierung:
Die Notch-Signalisierung ist ein weiterer entscheidender Weg bei der ILC-Differenzierung. Notch-Rezeptoren auf ILC-Vorläufern interagieren mit Notch-Liganden benachbarter Zellen und lösen eine Reihe von Ereignissen aus, die die Expression wichtiger Transkriptionsfaktoren beeinflussen. Die Notch-Signalisierung ist besonders wichtig bei der ILC2-Differenzierung, wo sie in Synergie mit GATA-3 wirkt.
Herausforderungen und zukünftige Richtungen:
Trotz erheblicher Fortschritte beim Verständnis der ILC-Differenzierung bleiben einige Fragen unbeantwortet. Die Plastizität von ILCs, die Faktoren, die ihre gewebespezifische Lokalisierung bestimmen, und die Regulierungsmechanismen, die ihre Reaktionen feinabstimmen, sind Bereiche aktiver Forschung. Die Aufklärung dieser Komplexität könnte zu neuen Therapiestrategien für immunbedingte Störungen und entzündliche Erkrankungen führen.
Abschluss:
Angeborene lymphatische Zellen stellen einen bemerkenswerten Zweig des Immunsystems dar, der an der Schnittstelle zwischen angeborener und adaptiver Immunität arbeitet. Ihre Differenzierung in verschiedene Untergruppen gewährleistet eine maßgeschneiderte und schnelle Reaktion auf verschiedene Herausforderungen und trägt zur Immunüberwachung und Gewebehomöostase bei. Der komplizierte Tanz von Transkriptionsfaktoren, Signalwegen und Mikroumgebungsreizen orchestriert die Differenzierung von ILCs und bietet einen faszinierenden Einblick in die Komplexität des Immunsystems. Die fortschreitende Forschung auf diesem Gebiet verspricht, neue Wege für therapeutische Interventionen aufzudecken und unser Verständnis der Immunregulation zu verbessern.
Verweise:
1. Artis, D. & Spits, H. (2015). Die Biologie angeborener lymphoider Zellen. Natur, 517(7534), 293–301. doi:10.1038/nature14189
2. Eberl, G. (2015). Entwicklung und Evolution von RORγt+-Zellen in der Welt einer Mikrobe. Immunologische Übersichten, 266(1), 56–73. doi:10.1111/imr.12299
3. Vivier, E., Artis, D., Colonna, M., Diefenbach, A., Di Santo, J. P., Eberl, G., Koyasu, S., Locksley, R. M., McKenzie, A. N. J., Mebius, R. E., Powrie , F., & Spits, H. (2018). Angeborene Lymphzellen: 10 Jahre später. Zelle, 174(5), 1054–1066. doi:10.1016/j.cell.2018.07.017
4. Klose, C.S.N. & Artis, D. (2016). Angeborene lymphoide Zellen als Regulatoren von Immunität, Entzündung und Gewebehomöostase. Nature Immunology, 17(7), 765–774. doi:10.1038/ni.3489
5. Diefenbach, A., Colonna, M. & Koyasu, S. (2014). Entwicklung, Differenzierung und Diversität angeborener lymphoider Zellen. Immunität, 41(3), 354–365. doi:10.1016/j.immuni.2014.09.005
6. Mjösberg, J., Bernink, J., Golebski, K., Karrich, J. J., Peters, C. P., Blom, B., te Velde, A. A., Fokkens, W. J., van Drunen, C. M. & Spits, H. ( 2012). Der Transkriptionsfaktor GATA3 ist für die Funktion menschlicher angeborener lymphoider Zellen vom Typ 2 essentiell. Immunität, 37(4), 649–659. doi:10.1016/j.immuni.2012.08.015
7. Dutton, E. E. & Gommerman, J. L. (2019). Angeborene lymphoide Zellen bei Autoimmunität und chronisch entzündlichen Erkrankungen. Current Opinion in Immunology, 61, 74–80. doi:10.1016/j.coi.2019.09.006
29th Jul 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024