Die Komplexität von Antikörpern entschlüsseln: leichte Ketten, schwere Ketten, konstante Regionen und tumorassoziierte Antigene
Antikörper, auch Immunglobuline genannt, spielen eine entscheidende Rolle bei der Fähigkeit des Immunsystems, Krankheitserreger zu erkennen und zu neutralisieren. Dieser umfassende Artikel befasst sich mit den strukturellen und funktionellen Nuancen von Antikörpern und konzentriert sich dabei auf die leichte Kette des Antikörpers, tumorassoziierte Antigene, konstante Regionen von Antikörpern und das Zusammenspiel zwischen schweren und leichten Ketten. Durch die detaillierte Untersuchung dieser Komponenten wollen wir das Verständnis ihrer Bedeutung in der Immunologie und ihrer Auswirkungen auf die Krebsforschung verbessern.
Inhalt
1. Einführung in Antikörper
2. Struktur von Antikörpern
Schwere Kette und leichte Kette
Konstante Antikörperregion
3. Leichte Kette des Antikörpers
Arten von Lichterketten
Rolle und Funktion
4. Tumorassoziierte Antigene
Definition und Bedeutung
Beispiele und klinische Relevanz
5. Schwere Kette und Lichterkette : Ein synergistisches Duo
Molekulare Interaktion
Funktionelle Implikationen
Eigenschaften und Funktionen
Klinische Anwendungen
7. Fazit
8.Referenzen
1. Einführung in Antikörper
Antikörper, auch Immunglobuline genannt, sind zentrale Elemente des adaptiven Immunsystems und werden sorgfältig hergestellt, um fremde Eindringlinge wie Viren, Bakterien und andere Krankheitserreger zu identifizieren und zu neutralisieren. Diese Y-förmigen Proteine werden von B-Zellen, einer Art weißer Blutkörperchen, als Reaktion auf den Nachweis von Antigenen synthetisiert, bei denen es sich um spezifische Moleküle oder molekulare Strukturen handelt, die häufig auf der Oberfläche von Krankheitserregern zu finden sind. Die einzigartige Architektur und biochemische Zusammensetzung von Antikörpern ermöglicht es ihnen, mit hoher Spezifität an Antigene zu binden und spielt somit eine entscheidende Rolle für die Fähigkeit des Immunsystems, sich an fremde Moleküle zu erinnern und diese anzugreifen.
2. Struktur von Antikörpern
Schwere Kette und leichte Kette
Schwere Kette und leichte Kette
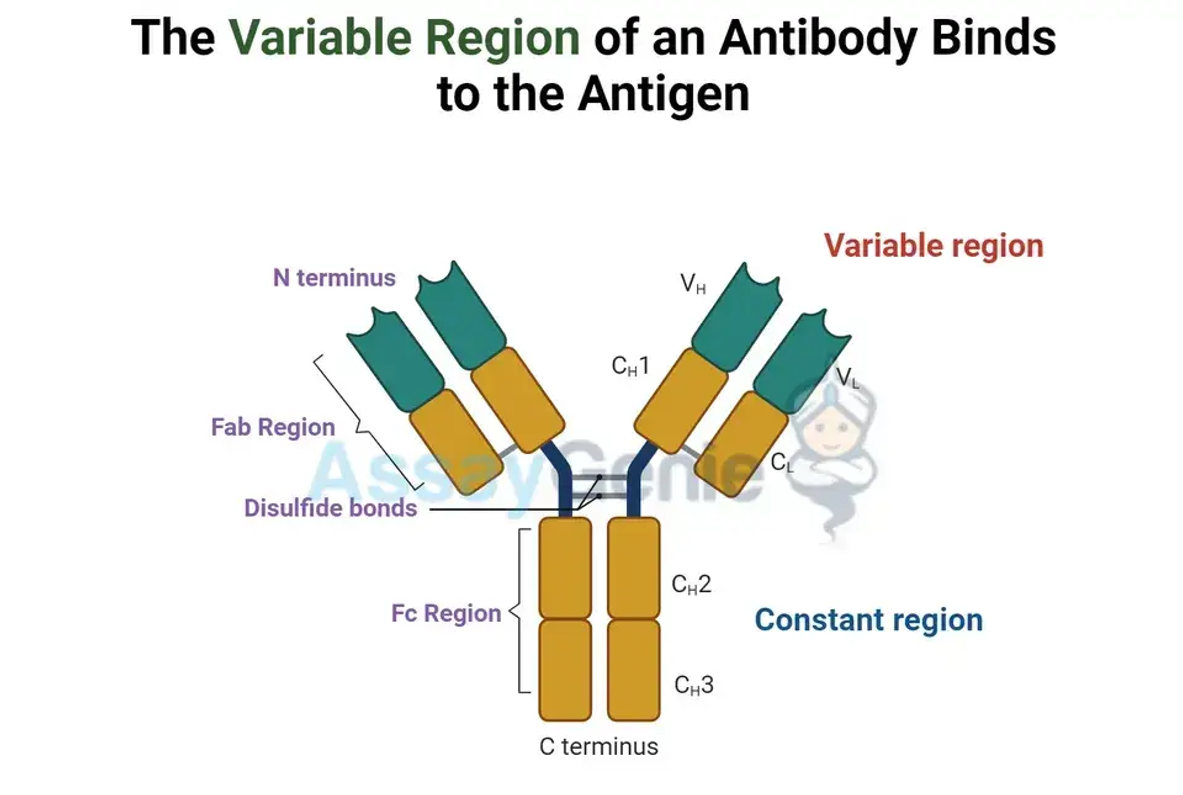
Das Antikörpermolekül ist in zwei primäre Regionen gegabelt: die Fab-Region (Antigen-bindende Region) und die Fc-Region (konstante Region). Die Fab-Region ist für die Antigenerkennung verantwortlich, während die Fc-Region Interaktionen mit Zelloberflächenrezeptoren und dem Komplementsystem vermittelt und so die Immunantwort beeinflusst.
Die schweren und leichten Ketten eines Antikörpers sind die Bausteine, die seine einzigartige Y-förmige Architektur definieren. Jede leichte Kette besteht aus einer variablen (VL) und einer konstanten (CL) Domäne, während jede schwere Kette je nach Antikörperklasse eine variable (VH) Domäne und drei bis vier konstante (CH) Domänen enthält. Die variablen Domänen der schweren und leichten Ketten bilden zusammen die Fab-Region des Antikörpers.

Die Fab-Region: Schlüssel zur Antigenerkennung
Die Fab-Region (Fragment Antigen-Binding) steht an vorderster Front der Abwehrstrategie des Antikörpers und ist für die spezifische Erkennung und Bindung von Antigenen verantwortlich. Diese Region umfasst die variablen Domänen sowohl der schweren als auch der leichten Kette (VH und VL), die zusammen eine einzigartige Antigenbindungsstelle bilden. Die Variabilität der Aminosäuresequenzen dieser Domänen ermöglicht ein vielfältiges Repertoire an Antikörpern, von denen jeder in der Lage ist, an ein spezifisches Antigen-Epitop zu binden. Diese Spezifität ist von grundlegender Bedeutung für die Fähigkeit des adaptiven Immunsystems, ein unglaublich breites Spektrum an Krankheitserregern anzugreifen und zu neutralisieren.
Die Fc-Region: Vermittler von Effektorfunktionen
Umgekehrt dient die Fc-Region (fragmentkristallisierbare Region), die hauptsächlich aus den konstanten Domänen der schweren Ketten (CH) besteht, als Effektordomäne des Antikörpers. Diese Region ist nicht an der Antigenbindung beteiligt, aber entscheidend für die Vermittlung von Interaktionen mit verschiedenen Komponenten des Immunsystems. Die Struktur der Fc-Region bestimmt den Isotyp des Antikörpers (z. B. IgA, IgD, IgE, IgG und IgM), der wiederum seine Rolle innerhalb der Immunantwort beeinflusst. Zu diesen Aufgaben gehören die Rekrutierung von Immuneffektorzellen, die Aktivierung der Komplementkaskade und die Erleichterung der Antigenpräsentation, was letztendlich zur Entfernung des Antigens aus dem Körper führt.

Konstante Region des Antikörpers: Bestimmung des Isotyps und Modulation der Immunantwort
Konstante Region des Antikörpers: Bestimmung des Isotyps und Modulation der Immunantwort
Die konstante Region eines Antikörpers, insbesondere innerhalb des Fc-Teils, spielt eine entscheidende Rolle bei der Bestimmung des Isotyps des Antikörpers. Dieser Bereich weist im Vergleich zu den variablen Bereichen eine geringere Variabilität auf und bietet einen stabilen Rahmen für klassenspezifische Funktionen. Der Isotyp eines Antikörpers beeinflusst, wie er mit anderen Elementen des Immunsystems interagiert, einschließlich
Rekrutierung von Effektorzellen: Verschiedene Fc-Rezeptoren auf Immunzellen haben unterschiedliche Affinitäten zu bestimmten Antikörper-Isotypen, was die Fähigkeit des Antikörpers beeinflusst, diese Zellen an der Infektionsstelle zu rekrutieren.
Aktivierung des Komplementsystems: Bestimmte Antikörperisotypen können die Komplementkaskade auslösen, eine Reihe enzymatischer Reaktionen, die zur Zerstörung des Krankheitserregers führen.
Transplazentarer Transfer: Die Fc-Region von IgG-Antikörpern erleichtert deren Übertragung durch die Plazenta und sorgt so für eine passive Immunität des Fötus.
Die strukturellen und funktionellen Eigenschaften der konstanten Region sind für die Gesamtwirksamkeit des Antikörpers bei der Immunabwehr von entscheidender Bedeutung und beeinflussen sowohl die direkte Neutralisierung von Krankheitserregern als auch die Orchestrierung umfassenderer Immunantworten.
Funktionen der konstanten Region
Bindung an Fc-Rezeptoren: Fc-Rezeptoren auf Immunzellen erkennen die konstante Region und erleichtern so die antikörperabhängige zelluläre Zytotoxizität (ADCC).
Komplementaktivierung: Die konstante Region kann den klassischen Komplementweg einleiten, der zur Pathogenlyse führt.
Neugeborenenimmunität: Bestimmte konstante Regionen ermöglichen es Antikörpern, die Plazenta zu passieren und dem Fötus eine passive Immunität zu verleihen.
Leichte Antikörperkette
Antikörpermoleküle, auch Immunglobuline genannt, sind wesentliche Bestandteile des adaptiven Immunsystems. Sie weisen eine bemerkenswerte Spezifität und Vielfalt auf und ermöglichen es ihnen, eine Vielzahl von Krankheitserregern und Fremdmolekülen zu identifizieren und zu neutralisieren. Im Mittelpunkt dieser Fähigkeit stehen zwei Arten von Leichtketten, Kappa (κ) und Lambda (λ), die beim Menschen in Antikörpern in einem Verhältnis von etwa 2:1 vorhanden sind. Diese leichten Ketten bilden zusammen mit den schweren Ketten die Antigen-Bindungsstellen eines Antikörpers und bestimmen dessen einzigartige Antigen-Bindungsaffinität und -Spezifität. Diese komplexe Anordnung untermauert nicht nur die strukturelle Integrität von Antikörpern, sondern spielt auch eine entscheidende Rolle bei der Fähigkeit des Immunsystems, eine Vielzahl von Antigenen zu erkennen und zu bekämpfen.
Arten von Lichterketten
Kappa (κ)-Ketten
Kappa-Ketten sind die vorherrschende Art von leichten Ketten, die in menschlichen Antikörpern vorkommen. Jede Kappa-Kette besteht aus einer variablen (V) und einer konstanten (C) Domäne. Die V-Domäne trägt zur Antigenbindungsstelle bei, während die C-Domäne mit anderen Komponenten des Immunsystems interagiert. Der genetische Ort, der die Kappa-Kette kodiert, weist eine beträchtliche Variabilität auf, die eine Quelle der Antigenbindungsspezifität und -diversität ist, die bei Antikörpern beobachtet wird. Diese Variabilität ermöglicht die Produktion eines riesigen Repertoires an Antikörpern, von denen jeder auf ein einzigartiges Antigen abzielen kann.
Lambda (λ)-Ketten
Obwohl Lambda-Ketten seltener vorkommen als Kappa-Ketten, spielen sie eine ebenso entscheidende Rolle bei der Immunantwort. Ähnlich wie Kappa-Ketten bestehen Lambda-Ketten aus variablen und konstanten Domänen, die zur Antigenbindungs- und Effektorfunktionen des Antikörpers beitragen. Die Gene der Lambda-Kette weisen außerdem eine erhebliche Variabilität auf, was weiter zur Fähigkeit des Immunsystems beiträgt, Antikörper mit hoher Spezifität gegen eine Reihe von Antigenen zu erzeugen.

Tabelle 1: Vergleich der leichten Kappa- und Lambda-Ketten
Besonderheit | Kappa (κ)-Kette | Lambda (λ)-Kette |
Verteilung | ~60 % der Antikörper beim Menschen | ~40 % der Antikörper beim Menschen |
Genetische Loci | κ-Locus auf Chromosom 2 | λ-Locus auf Chromosom 22 |
Kettenlänge | Etwas kürzer | Ein wenig länger |
Rolle und Funktion
Die Hauptfunktion von Leichtketten besteht darin, zu den Antigenbindungsstellen eines Antikörpers beizutragen, sodass dieser Antigene spezifisch erkennen und an sie binden kann. Diese Fähigkeit zur Antigenbindung ist von grundlegender Bedeutung für die Rolle des Antikörpers bei der Immunantwort, bei der er Krankheitserreger neutralisieren, sie zur Zerstörung markieren oder ihre Aktivität blockieren kann. Darüber hinaus ist die Spezifität der Antigenerkennung, die durch die Vielfalt der leichten Ketten ermöglicht wird, von entscheidender Bedeutung für die Fähigkeit des Immunsystems, zwischen sich selbst und nicht-selbst zu unterscheiden, Autoimmunreaktionen zu verhindern und gleichzeitig Infektionen wirksam zu bekämpfen.
Tumorassoziierte Antigene: Bedeutung in der Krebsimmunologie
Tumor-assoziierte Antigene (TAAs) sind Proteine, die auf der Oberfläche von Tumor-zellen exprimiert werden. Sie können vom Immunsystem als Ziele für Antikörper-vermittelte Reaktionen erkannt werden.
Das Verständnis der Tumor-assoziierten Antigene (TAAs) ist für die Weiterentwicklung der Krebsimmuntherapie von entscheidender Bedeutung. Hier gehen wir tiefer auf die drei Haupttypen von TAAs ein: überexprimierte Antigene, mutierte Antigene und Krebs-Hoden-Antigene, und bieten einen kurzen Überblick mit strukturierten Informationen zur Verdeutlichung.

Arten tumorassoziierter Antigene
TDas Verständnis der Tumor-assoziierten Antigene (TAAs) ist für die Weiterentwicklung der Krebs immuntherapie von entscheidender Bedeutung. Hier tauchen wir tiefer in die drei wichtigsten Arten von TAAs ein:
1. Überexprimierte Antigene
2. Mutierte Antigene
3. Krebs-Hoden-Antigene,
1. Überexprimierte Antigene
Normale zelluläre Proteine, die in Krebszellen in viel höheren Mengen vorhanden sind als ihre normalen Gegenstücke. Ihre Überexpression kann zum bösartigen Phänotyp von Krebszellen beitragen und sie zu Zielen für die Immuntherapie machen.
Beispiele und Bedeutung
HER2/neu: Wird bei bestimmten Arten von Brustkrebs überexprimiert und wird von monoklonalen Antikörpern (z. B. Trastuzumab) angegriffen.
CD20: Wird auf der Oberfläche von B-Zellen gefunden und wird bei Non-Hodgkin-Lymphomen mit Rituximab angegriffen.
Antigen | Krebstyp | Therapeutisches Ziel |
Brustkrebs | HER2/neu | Trastuzumab |
CD20 | Non-Hodgkin-Lymphom | Rituximab |
2. Mutierte Antigene
Antigene, die durch Mutationen im Tumor-zellgenom entstehen. Diese Mutationen können zur Produktion abnormaler Proteine führen, die vom Immunsystem als fremd erkannt werden und eine Grundlage für eine gezielte Therapie bilden.
Beispiele und Bedeutung
EGFRvIII: Eine Variante des EGF-Rezeptors, mutiert in einer Untergruppe von Glioblastomen, auf die eine Impfstofftherapie abzielt.
BRAF V600E: Mutation im Melanom, auf die niedermolekulare Inhibitoren (z. B. Vemurafenib) abzielen.
Tabelle 2: Mutierte Antigene
Antigen | Krebstyp | Therapeutisches Ziel |
EGFRvIII | Glioblastom | Impftherapie |
BRAF V600E | Melanom | Vemurafenib |
3. Krebs-Hoden-Antigene
Eine Klasse von TAAs, die normalerweise nur in männlichen Keimbahnzellen (z. B. Hoden) exprimiert werden, in verschiedenen Tumoren jedoch abweichend exprimiert werden. Sie sind immunogen und gelten aufgrund ihrer eingeschränkten normalen Gewebeexpression als vielversprechende Ziele für Krebsimpfstoffe und andere Immuntherapien.
Beispiele und Bedeutung
MAGE-A3: Wird bei Melanomen, Lungenkrebs und anderen Krebsarten exprimiert, auf die eine Impftherapie abzielt.
NY-ESO-1: Breite Expression bei verschiedenen Krebsarten, auf die T-Zell-basierte Therapien und Impfstoffe abzielen.

Tabelle 3: Krebs-Hoden-Antigene
Antigen | Krebstyp | Therapeutisches Ziel |
MAGIER-A3 | Melanom, Lungenkrebs | Impftherapie |
NY-ESO-1 | Verschiedene Krebsarten | T-Zell therapie, Impfstoffe |
Jede Art von TAA bietet einzigartige Möglichkeiten zur präzisen Bekämpfung von Krebserkrankungen. Überexprimierte Antigene ermöglichen ein Targeting auf der Grundlage quantitativer Unterschiede im Proteingehalt, mutierte Antigene bieten eine Spezifität, die sich aus krebsspezifischen Mutationen ergibt, und Krebs-Hoden-Antigene stellen Ziele mit begrenzter Expression in normalen Geweben dar. Fortschritte beim Verständnis und der gezielten Bekämpfung dieser Antigene sind der Schlüssel zur Entwicklung wirksamerer und weniger toxischer Krebstherapien.
Abschluss
Antikörper stehen mit ihren vielfältigen Strukturen und Funktionen an vorderster Front der Immunabwehr gegen Krankheitserreger, darunter auch Krebszellen. Die Spezifität der leichten Kette, die Effektorfunktionen der konstanten Region und die Fähigkeit, tumorassoziierte Antigene anzugreifen, veranschaulichen die Komplexität und Effizienz der Immunantwort. Mit fortschreitender Forschung wird ein detaillierteres Verständnis dieser Komponenten die Therapiestrategien gegen Infektionskrankheiten und Krebs verbessern.
Verweise
1. Janeway, C. A., Travers, P., Walport, M. und Shlomchik, M. J. (2001). Immunbiologie: Das Immunsystem in Gesundheit und Krankheit. 5. Auflage. Girlandenwissenschaft.
2. Murphy, K. & Weaver, C. (2016). Janeways Immunbiologie. 9. Auflage. Girlandenwissenschaft.
3. Klein, J. & Sato, A. (2000). Das HLA-System. New England Journal of Medicine, 343(10), 702-709.
4. Pardoll, DM (2012). Die Blockade von Immun-Checkpoints in der Krebsimmuntherapie. Nature Reviews Krebs, 12(4), 252-264.
5. Weiner, L. M., Surana, R. & Wang, S. (2010). Monoklonale Antikörper: Vielseitige Plattformen für die Krebsimmuntherapie. Nature Reviews Immunology, 10(5), 317-327.
6. Ohashi, P. S. (2002). Tumorimmunität und Autoimmunität: Ein Balanceakt. Nature Immunology, 3(4), 337-339.
7. Melief, C. J. & van Hall, T. (2012). Therapeutische Krebs impfstoffe. Journal of Clinical Investigation, 122(10), 3395-3400.
8. Coulie, P. G., Van den Eynde, B. J., van der Bruggen, P. & Boon, T. (2014). Von T-Lymphozyten erkannte Tumorantigene: Das Herzstück der Krebsimmuntherapie. Nature Reviews Krebs, 14(2), 135-146.
4th Jul 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024