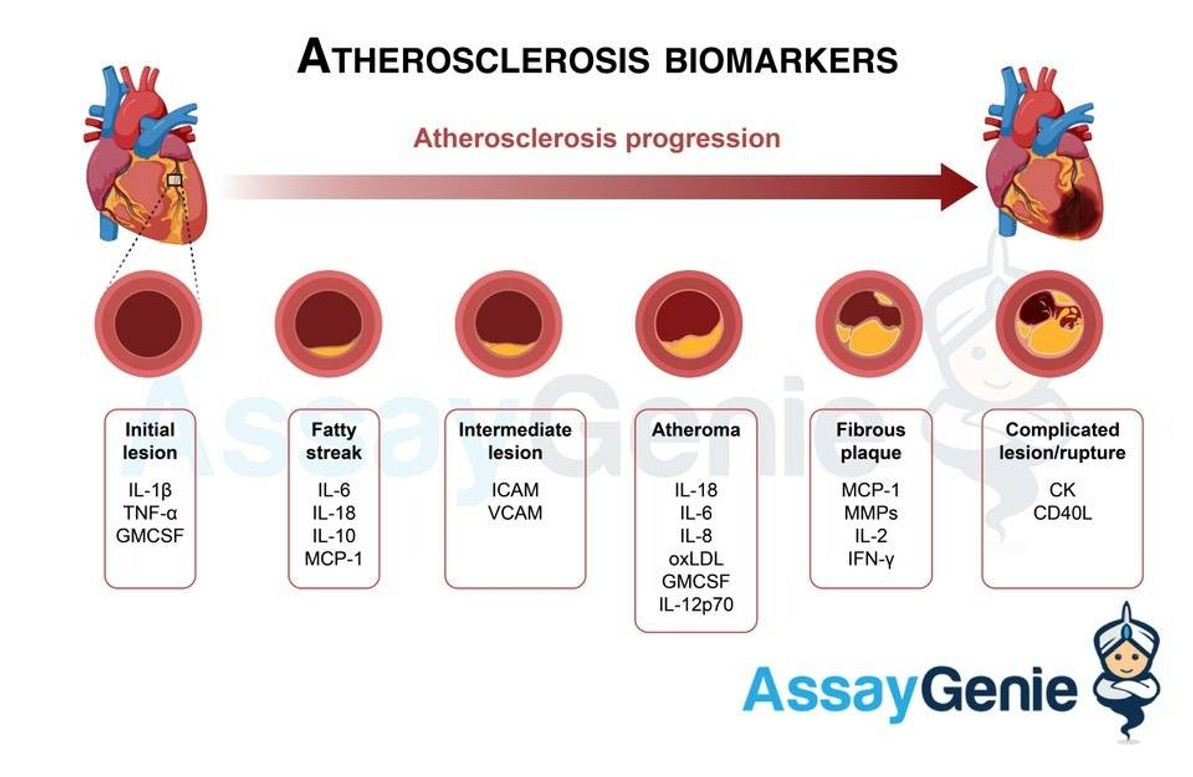
Biomarker und Entzündungsmarker für Arteriosklerose
Da es sich bei Atherosklerose um eine komplexe entzündliche Erkrankung handelt, gibt es viele einflussreiche Biomarker, die zum Fortschreiten der Krankheit beitragen, sowie Biomarker für mit Atherosklerose zusammenhängende Krankheiten wie Parodontitis und Autoimmunerkrankungen wie Diabetes, RA, SLE. Biomarker können Proteine, DNA und mRNA sein, die gemessen werden, um biologische, pathologische Prozesse und pharmakologische Reaktionen zu beurteilen. Biomarker können je nach Krankheitsstadium in frühe, prädiktive und prognostische Biomarker eingeteilt werden (Huang et al., 2010).
Die Identifizierung von Biomarkern für Krankheiten und die Suche nach therapeutischen Zielen ist von entscheidender Bedeutung für Forschung und Behandlung und insgesamt für die Sterblichkeits- und Morbiditätsrate der Bevölkerung (Uno und Nicholls, 2010). Ein guter Ansatz zur Untersuchung von Biomarkern bei einer fortschreitenden Krankheit wie Arteriosklerose, bei der es Jahrzehnte dauern kann, bis sich Symptome zeigen, wäre die Identifizierung separater Marker, die mit den verschiedenen Stadien der Krankheit verbunden sind. Die laufende Forschung hat sich jedoch insbesondere auf einige der folgenden pro- und entzündungshemmenden Mediatoren konzentriert. Atherosklerotische assoziierte Zellen, wie bereits erwähnt: ECs, SMCs und Makrophagen sind allesamt Produzenten wichtiger Biomarker.
Entzündungshemmende Zytokine: Interleukin 10 (IL-10)
IL-10 wird als pleiotropes entzündungshemmendes Lymphokin klassifiziert, das die Expression von IFN-gamma, TNF-alpha, GM-CSF und die Proliferation von T-Zellen unterdrückt. Damit das Immunsystem voll funktionsfähig ist, muss im Körperkreislauf ein Gleichgewicht zwischen entzündungsfördernden und entzündungshemmenden Molekülen bestehen. Über einen IL-10-Mangel wurde bei zahlreichen Erkrankungen im Zusammenhang mit Entzündungen berichtet, darunter RA und SLE (Pyo et al., 2003) sowie UAS. Patienten weisen ein Ungleichgewicht der TNF-α- und IL-10-Spiegel im Serum auf (Waehre et al., 2002). ). Ein IL-10-Mangel bei Arteriosklerose führt zu einer Zunahme der Bildung von Fettstreifen sowie der proteolytischen und gerinnungshemmenden Aktivität (Caligiuri et al., 2003), da es die Produktion von Th1-Zytokinen hemmt (Fiorentino et al., 1991) und die Produktion von CC-Chemokinen verringert, was zur Folge hätte Das Homing und Herunterregulieren von Leukozyten reguliert ICAM-1. Es trägt auch zur Verhinderung der Plaque-Destabilisierung bei, indem es die MMP-Produktion reduziert. Allerdings variieren die Serumspiegel von IL-10 bei Patienten wie bei anderen Zytokinen, die an Atherosklerose beteiligt sind, je nach Studie und Krankheitstyp (Stenvinkel et al., 2005). IL-10 spielt eine kreuzregulierende Rolle mit IL-12 und hemmt dessen oxLDL-induzierte Freisetzung (Uyemura et al., 1996).
Überwiegend proinflammatorische Zytokine: Tumornekrosefaktor Alpha (TNF-α)
TNF-alpha ist ein pleiotropes proinflammatorisches Zytokin und wird hauptsächlich von Monozyten und Makrophagen exportiert. TNF signalisiert über den TNF-Rezeptor (TNFR) (Fragoso et al., 2013). TNFR kommt auf Endothelzellen vor und aktiviert letztendlich NF-Kappa Beta, das für das Überleben, die Proliferation, die Entzündung und die Immunregulation der Zellen verantwortlich ist. Viele Entzündungsmarkergene bestehen aus einer NF-kappa-Beta-Promotorregion. Wenn die Proteinexpression durch TNF-α reguliert wird, kann sie daher als proinflammatorischer Marker betrachtet werden. Es ist an allen Stadien der Atherombildung beteiligt: Beginn, Entwicklung, Anfälligkeit, Schweregrad und Reaktion auf die Behandlung (Fragoso et al., 2013). TNF-α ist an der Produktion von Chemokinen (IL-6, CRP) und Zytokinen, der Expression von Adhäsionsmolekülen (ICAM-1, VCAM-1), der Rekrutierung von Leukozyten, der Induktion der Proliferation glatter Muskelzellen und dem Lipidstoffwechsel beteiligt (verringert HDL). Aktivität) (Bruunsgaard et al., 2000). Die TNF-α-Konzentration ist in Intimaverdickungen atherosklerotischer Aorten 200-mal höher als in entsprechenden Serumproben (Rus und Vlaicu, 1991). Eine Studie an Patienten mit RA und AS, die ein Jahr lang mit Anti-TNF-α behandelt wurden, zeigte eine signifikante Verringerung der Aortensteifheit (Angel et al., 2012).
Interferon Gamma (IFN-γ)
IFN-γ ist das einzige Typ-II-Interferon, Typ-I-Interferone umfassen α, β und δ. Zu den Zellen, die IFN-gamma produzieren, gehören aktivierte T-Lymphozyten (CD4+ Th1-Zellen), natürliche Killerzellen, Monozyten/Makrophagen, dendritische Zellen und B-Zellen. Die von antigenpräsentierenden Zellen freigesetzten Zytokine IL-12 und IL-18 aktivieren die IFN-γ-Sekretion aus diesen Zellen. IFN-gamma hat mehrere proatherogene Funktionen. Die IFN-Gamma-Signalisierung aktiviert Immunzellen wie T-Zellen, Makrophagen und NK-Zellen, Moleküle des Haupthistokompatibilitätskomplexes (MHC) der Klassen I und II, die Zytokinproduktion und erhöht die Expression von Adhäsionsmolekülen und Chemokinen an der Läsionsstelle. (Harvey und Ramji, 2005, Tenger et al., 2005). IFN-gamma ist als entzündungsförderndes Zytokin bekannt, spielt aber wahrscheinlich sowohl eine entzündungsfördernde als auch eine entzündungshemmende Rolle bei Arteriosklerose (Muhl und Pfeilschifter, 2003). IFN-gamma ist als entzündungsförderndes Zytokin an mehreren Stadien der Atherosklerose beteiligt: Schaumzellbildung, Immunantwort und Plaqueentwicklung (McLaren et al., 2009). Therapeutika, die sich nur auf dieses Zytokin konzentrieren, haben ein enormes Potenzial zur Verhinderung der Atheromentwicklung. Eine Studie zeigt, dass die IFN-gamma-Neutralisierung durch ein Plasmid, das für lösliches IFN-γR kodiert, das Fortschreiten der Läsion in Mausmodellen reduzierte (Gotsman und Lictman, 2007).
Interleukin 6 (IL-6)
IL-6 ist ein Glykoprotein, das von Monozyten/Makrophagen, Fettgewebe und Endothelzellen produziert wird. IL-6 stimuliert die SMC-Proliferation, die MCP-1-Sekretion aus Makrophagen und die ICAM-1-Expression auf ECs. Erhöhte IL-6-Plasmakonzentrationen wurden mit Morbiditäts- und Mortalitätsraten bei instabiler Angina pectoris in Verbindung gebracht (Koenig und Khuseyinova, 2007). Bei Patienten mit der Halsschlagader und der Koronararterie wies IL-6 signifikant höhere Expressionsniveaus auf als die Kontrollen und korrelierte mit dem Lumendurchmesser der gemeinsamen Halsschlagader und wurde als nützlicher Biomarker angesehen (Larsson et al., 2005). IL-6 und IL-8 zeigten deutlich höhere Konzentrationen in fibrösem Plaque als in der normalen Arterienwand (Rus et al., 1996).
Interleukin 2 (IL-2)
IL-2 ist ein bekannter angiogener Faktor, der über mehrere Induktoren verfügt, darunter IL-4, IL-6, TNF-alpha und sich selbst. Es wurde gezeigt, dass es bei Patienten mit koronarer Herzkrankheit (KHK) und stabiler Angina pectoris (SA) erhöht ist, nicht jedoch bei Patienten mit akutem Koronarsyndrom (ACS) (Ozeren et al., 2003). In einer Studie zur Karotis-Endarteriektomie von Frostegard et al. war das Ungleichgewicht von pro- und antiinflammatorischen Zytokinen deutlich unterschiedlich, IL-2 und IFN-gamma waren in 30–50 % der Plaques vorhanden (Frostegard et al., 1999).
Granulozyten-Makrophagen-Kolonie-stimulierender Faktor (GMCSF)
GM-CSF ist ein Zytokin, das für die Differenzierung von Vorläuferzellen in reife Granulozyten und Makrophagen und die Proliferation von DCs verantwortlich ist (Alberts-Grill et al., 2013). Es ist ein wichtiger Mediator in der Reaktion auf die Verletzungsphase der Entzündungsentstehung. Protein- und mRNA-Studien haben das Vorhandensein von GM-CSF in nicht erkrankten Arterien und seine Hochregulierung in atherosklerotischen menschlichen Koronararterien bestätigt (Plenz et al., 1997). Die Expression von GM-CSF in erkrankten Arterien kann auf die übermäßige Menge an oxLDL zurückzuführen sein, das die Freisetzung von Zytokinen durch Endothelzellen induziert. Die Fähigkeit von GM-CSF, Granulozyten und Makrophagen zu regulieren, trägt zur Plaqueprogression bei (Shaposhnik et al., 2007).
Interleukin 1 Beta (IL-1β)
Von der IL-1-Familie ist IL-1 beta die am häufigsten im Menschen zirkulierende Isoform. Gefäßzellen können IL-1β-Signale sowohl produzieren als auch Ziele davon sein. IL-1β signalisiert über den MAPK-Weg, indem es an IL-1RI (Rezeptor) bindet und TFs und NF-ĸβ aktiviert, was zu einer proinflammatorischen Genexpression führt (Chamberlain et al., 2006). Bei Arteriosklerose gilt IL-1β in allen Krankheitsstadien als wesentlicher Faktor; es erhöht die Expression von Adhäsionsmolekülen, die Gefäßpermeabilität und die SMC-Proliferation (Apostolakis et al., 2008).
Interleukin 12p70 (IL-12p70)
IL-12 ist ein wichtiger Regulator der Th1- und Th2-Zellantworten. Es wird von aktivierten Monozyten produziert und ist ein T-Zell-Wachstumsfaktor. Die IL-12-Expression kann durch Monozytenaktivierung durch oxLDL initiiert werden, nicht jedoch durch minimal modifiziertes (MM)-LDL. IL-12 p40-mRNA und IL-12 p70-Protein wurden in Atheromen reichlich gefunden (Uyemura et al., 1996).
Interleukin 18 (IL-18)
Il-18 gehört neben IL-1β zur IL-1-Familie. Eine Vielzahl von Zellen exprimieren dieses entzündungsfördernde IFN-γ-induzierende Zytokin, beispielsweise Monozyten/Makrophagen, T- und B-Zellen, dendritische Zellen und Epithelzellen (Apostolakis et al., 2008). Das IL-18-Gen befindet sich auf Chromosom 11: Position 11q22.2-q22.3 (Okamura et al., 1995).
IL-18 wird mit entzündlichen Erkrankungen wie rheumatoider Arthritis, systemischem Lupus erythematodes und Hauterkrankungen, Psoriasis und atopischer Dermatitis in Verbindung gebracht (Sims und Smith, 2010). Im Gegensatz zu den meisten Zytokinen wird IL-18 ohne ein Stimulans konstitutiv exprimiert. Bei Arteriosklerose spielt IL-18 viele Rollen; Es induziert die Zytokine GM-CSF, TNF-α, IL-1β, IL-6 und das Chemokin IL-8, die erheblich zur chronischen Entzündung an der Stelle der Läsionsentwicklung beitragen. Der am besten untersuchte Einfluss von IL-18 auf Immunzellen ist seine Fähigkeit, eine starke Menge IFN-γ aus Th1-Zellen zu stimulieren. Eine Kombination von IL-12 und IL-18 erzeugt auch IFN-γ auf einem breiteren Spektrum von Zellen, CD8+ T-Zellen, B-Zellen und NK-Zellen (Arend et al., 2008).
IL-18-Studien haben gezeigt, dass IL-18 zusammen mit Makrophagen in atherosklerotischen Läsionen lokalisiert ist, während es in gesunden Arterienregionen fehlt. In Mausmodellen verstärkt IL-18 die Atherosklerose durch die Freisetzung von IFN-γ (Whitman et al., 2002). Außerdem korrelierten erhöhte IL-18-Spiegel in Atheromen der Karotis und der Aorta mit dem zunehmenden Potenzial einer Plaque-Destabilisierung. Studien zeigen jedoch widersprüchliche Ergebnisse, die die Rolle von IL-18 je nach Versuchsmodell als pro- oder antiatherosklerotisch beschreiben (Arend et al., 2008). Es wurde gezeigt, dass IL-18 zusammen mit IFN-γ einen Einfluss auf die Erhöhung der CXCL16-Expression in Läsionen hat (Tenger et al., 2004). In glatten Muskelzellen der Aorta wird die CXCL16-abhängige ASMC-Proliferation durch IL-18 vermittelt (Chandrasekar et al., 2005). Neben Immunzellen hat IL-18 auch einen Einfluss auf die Expression von Endothelzellen. IL-18 reguliert die Adhäsionsmoleküle ICAM-1 und VCAM-1 hoch (Apostolakis et al., 2008).
Zusätzliche Ressourcen




17th Aug 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024