Biomarker-Tests: Fortschritte, Anwendungen und zukünftige Richtungen
Biomarker, messbare Indikatoren für biologische Prozesse oder Reaktionen auf therapeutische Interventionen, spielen in der modernen Gesundheitsversorgung eine zentrale Rolle. Sie liefern Ärzten wertvolle Informationen zur Krankheitserkennung, Prognosebeurteilung und Behandlungsoptimierung. Biomarker-Tests umfassen eine breite Palette von Techniken und Plattformen, die von einfachen Immunoassays bis hin zu anspruchsvollen Genomanalysen reichen. In den letzten Jahrzehnten haben bedeutende Fortschritte in der Biomarkerforschung die klinische Praxis revolutioniert und zu personalisierteren und präziseren Ansätzen für die Patientenversorgung geführt.
Arten von Biomarkern:
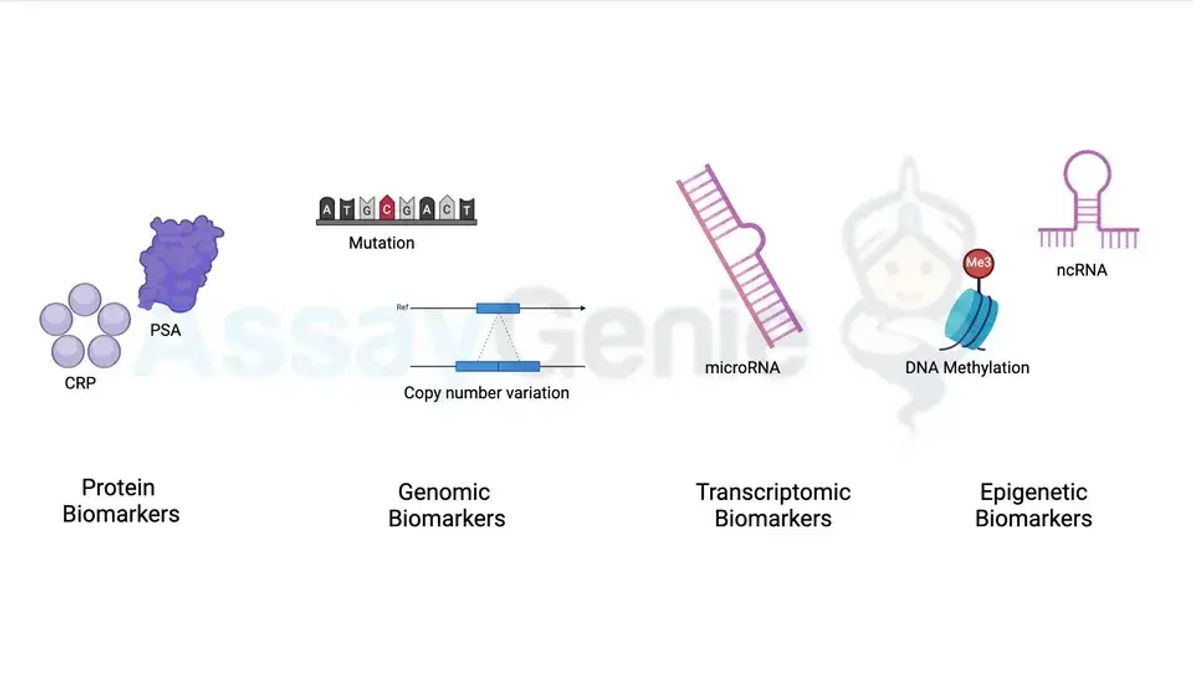
Biomarker umfassen eine Vielzahl molekularer Einheiten, die verschiedene Aspekte der Krankheitspathologie und des Ansprechens auf die Behandlung widerspiegeln. Proteinbiomarker wie C-reaktives Protein (CRP) und Prostata-spezifisches Antigen (PSA) dienen seit langem als zuverlässige Indikatoren für die Diagnose und Überwachung des Krankheitsverlaufs. Jüngste Fortschritte bei Hochdurchsatztechnologien haben jedoch die Identifizierung von Biomarkern auf genomischer, transkriptomischer und epigenomischer Ebene ermöglicht.
Genomische Biomarker, darunter Mutationen, Variationen der Kopienzahl und Genexpressionsprofile, bieten Einblicke in die zugrunde liegenden molekularen Mechanismen von Krankheiten wie Krebs. Beispielsweise kann der Nachweis spezifischer Mutationen im EGFR-Gen bei Patienten mit nichtkleinzelligem Lungenkrebs die Reaktion auf EGFR-zielgerichtete Therapien wie Erlotinib und Gefitinib vorhersagen. Transkriptomische Biomarker wie microRNA-Signaturen liefern zusätzliche Informationsebenen zu Genexpressionsmustern und regulatorischen Netzwerken.
Epigenetische Biomarker, die DNA-Methylierungsmuster, Histonmodifikationen und nichtkodierende RNA-Moleküle umfassen, spiegeln das dynamische Zusammenspiel zwischen genetischer Veranlagung und Umweltfaktoren wider. Veränderungen epigenetischer Merkmale werden mit verschiedenen Krankheiten in Verbindung gebracht, darunter Krebs, Herz-Kreislauf-Erkrankungen und neurodegenerative Erkrankungen.
Aufstrebende Bereiche wie Metabolomik und Proteomik bieten beispiellose Möglichkeiten für die Entdeckung und Validierung von Biomarkern. Metabolomisches Profiling ermöglicht die umfassende Analyse niedermolekularer Metaboliten in biologischen Proben und liefert Einblicke in metabolische Dysregulationen, die mit Krankheitszuständen einhergehen. In ähnlicher Weise ermöglichen proteomische Ansätze die Identifizierung und Quantifizierung von Proteinen, die an Signalwegen, zellulären Prozessen und der Pathogenese von Krankheiten beteiligt sind.
Klinische Anwendungen:
Biomarker-Tests haben transformative Auswirkungen auf verschiedene medizinische Fachgebiete und erleichtern die Früherkennung von Krankheiten, die prognostische Beurteilung und personalisierte Behandlungsstrategien. In der Onkologie spielen Biomarker eine zentrale Rolle bei der Krebsvorsorge, der molekularen Subtypisierung und der Vorhersage des Ansprechens auf gezielte Therapien. Das Vorhandensein einer HER2/neu-Amplifikation bei Brustkrebspatientinnen leitet beispielsweise die Verabreichung von HER2-zielgerichteten Wirkstoffen wie Trastuzumab, wodurch die klinischen Ergebnisse verbessert und das Risiko eines erneuten Auftretens der Krankheit verringert werden.
In der Kardiologie spielen Biomarker wie Troponin und das natriuretische Peptid vom B-Typ (BNP) eine wichtige Rolle bei der Diagnose eines akuten Myokardinfarkts bzw. einer Herzinsuffizienz. Erhöhte Troponinspiegel weisen auf eine Myokardschädigung hin, während erhöhte BNP-Werte auf eine Myokardbelastung und eine ventrikuläre Dysfunktion hinweisen. Diese Biomarker unterstützen Ärzte bei der Risikostratifizierung, der therapeutischen Entscheidungsfindung und der Überwachung des Krankheitsverlaufs.
Bei Infektionskrankheiten ermöglichen Biomarker-Panels die Unterscheidung zwischen viralen und bakteriellen Infektionen, steuern eine geeignete Antibiotikatherapie und verringern das Risiko antimikrobieller Resistenzen. Beispielsweise hat sich gezeigt, dass die Verwendung von Procalcitonin als Biomarker die Antibiotikakontrolle bei Patienten mit Verdacht auf Sepsis oder Infektionen der unteren Atemwege erleichtert.
Darüber hinaus sind biomarkerbasierte Begleitdiagnostika zu einem integralen Bestandteil der Entwicklung und Zulassung neuartiger Therapeutika geworden und stellen sicher, dass Patienten Behandlungen erhalten, die auf ihr molekulares Profil zugeschnitten sind. Begleitdiagnostik hilft dabei, Patientenpopulationen zu identifizieren, die am wahrscheinlichsten von bestimmten Therapien profitieren, wodurch die Therapieergebnisse optimiert und Nebenwirkungen minimiert werden.
Herausforderungen und zukünftige Richtungen:
Trotz ihres immensen Potenzials stellen die Entdeckung und Validierung von Biomarkern mehrere Herausforderungen dar, die angegangen werden müssen, um ihren vollen klinischen Nutzen auszuschöpfen. Schwankungen bei der Probenentnahme, Assay-Standardisierung und Dateninterpretation können die Reproduzierbarkeit und Zuverlässigkeit von Biomarker-Ergebnissen beeinträchtigen und deren Umsetzung in die klinische Praxis behindern. Darüber hinaus erfordert die Heterogenität vieler Krankheiten die Integration von Multi-Omics-Daten, um ihre Komplexität angemessen zu erfassen.
Fortschritte in der Bioinformatik und in Techniken des maschinellen Lernens versprechen eine Entschlüsselung komplexer Biomarker-Signaturen und eine genauere Vorhersage klinischer Ergebnisse. Die Integration verschiedener Omics-Datensätze, einschließlich Genomik, Transkriptomik, Proteomik und Metabolomik, kann zu einem umfassenden Verständnis der Krankheitsmechanismen und therapeutischen Ziele führen. Darüber hinaus könnte die Entwicklung nicht-invasiver Biomarker wie Flüssigbiopsien und bildgebender Biomarker die Erkennung und Überwachung von Krankheiten revolutionieren und eine Echtzeitbewertung des Behandlungserfolgs und des Krankheitsverlaufs ermöglichen.
Abschluss:
Biomarker-Tests stellen einen Eckpfeiler der modernen Medizin dar, da sie Einblicke in die Krankheitsbiologie bieten und die klinische Entscheidungsfindung leiten. Von traditionellen Proteinmarkern bis hin zu hochmodernen genomischen Signaturen haben Biomarker die Landschaft der Diagnostik und Therapie in verschiedenen medizinischen Disziplinen verändert. Auf dem Weg in eine Ära der personalisierten Medizin und der präzisen Gesundheitsversorgung werden kontinuierliche Investitionen in die Biomarker-Forschung und -Technologie von entscheidender Bedeutung für die Verbesserung der Patientenergebnisse und die Weiterentwicklung des medizinischen Wissens sein.
Verweise:
Anderson NL, Anderson NG. Das menschliche Plasmaproteom: Geschichte, Charakter und diagnostische Aussichten. Mol-Zell-Proteomik. 2002;1(11):845-867.
Diamandis EP. Krebsbiomarker: Können wir die jüngsten Misserfolge in Erfolge verwandeln? J Natl Cancer Inst. 2010;102(19):1462-1467.
Sawyers C. Gezielte Krebstherapie. Natur. 2004;432(7015):294-297.
Januzzi JL, van Kimmenade R, Lainchbury J, et al. NT-proBNP-Tests zur Diagnose und kurzfristigen Prognose bei akuter destabilisierter Herzinsuffizienz: eine international gepoolte Analyse von 1256 Patienten: die International Collaborative of NT-proBNP Study. Eur Heart J. 2006;27(3):330-337.
Machado M, Kefalakes H, Joshi MS. Die Rolle des C-reaktiven Proteins bei Herz-Kreislauf-Erkrankungen. Int J Cardiol. 2015;189:276-278.
28th Jun 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024