Auswahl eines fluoreszierenden Proteins: Ein umfassender Leitfaden
Fluoreszierende Proteine verstehen
- Die Grundlagen der Fluoreszenz
Fluoreszenz tritt auf, wenn eine Substanz Licht einer Wellenlänge absorbiert (Anregung) und dann Licht einer längeren Wellenlänge emittiert (Emission). FPs verfügen über einzigartige Anregungs- und Emissionsspektren, wodurch sie vor biologischen Hintergründen identifizierbar und quantifizierbar sind.
- Die Evolution fluoreszierender Proteine
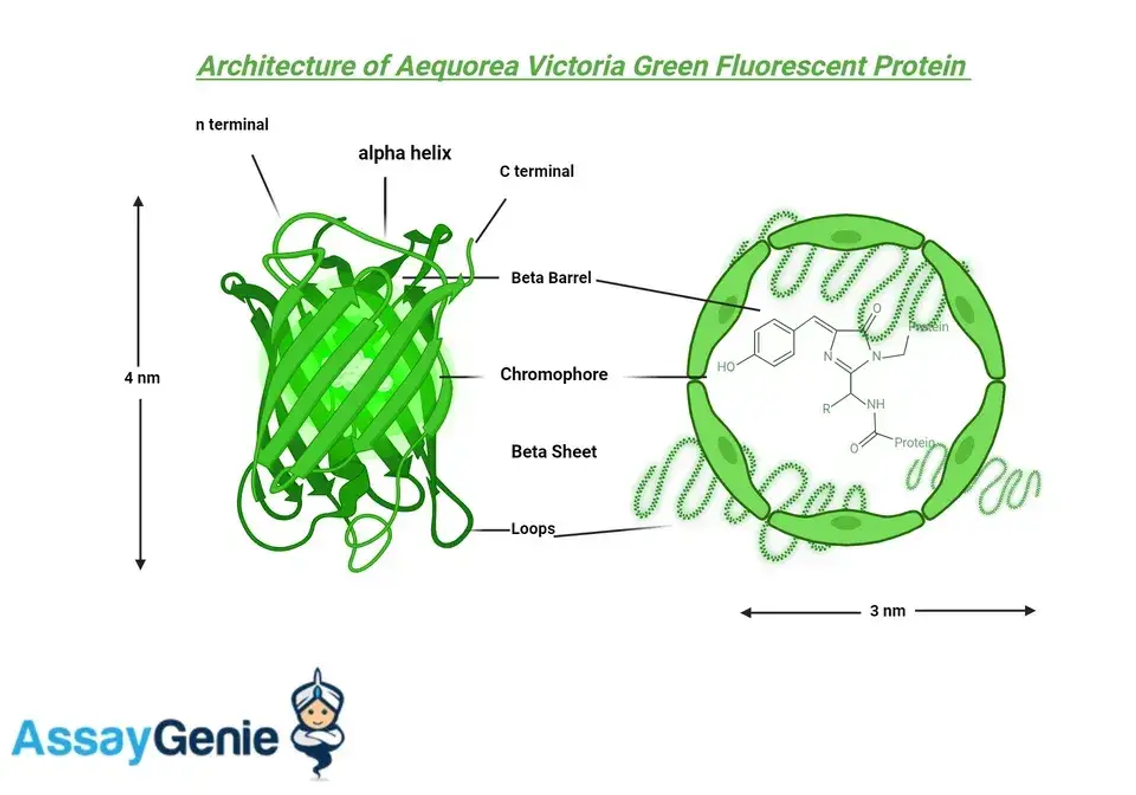
Seit dem Klonen von GFP in den frühen 1990er Jahren haben Forscher durch Mutagenese und Protein-Engineering zahlreiche Varianten entwickelt. Diese Bemühungen haben nicht nur die Helligkeit und Fotostabilität verbessert, sondern auch das Farbspektrum der FPs von Blau bis Dunkelrot erweitert.
Schlüsselfaktoren bei der Auswahl eines fluoreszierenden Proteins
- Spektrale Eigenschaften
Die Wahl des FP hängt stark von seinen spektralen Eigenschaften ab, einschließlich der Anregungs- und Emissionswellenlängen. Für die Mehrfarbenbildgebung ist die Auswahl von FPs mit nicht überlappenden Spektren von entscheidender Bedeutung, um Übersprechen zu vermeiden und eine klare Trennung der Signale sicherzustellen.
- Helligkeit und Photostabilität
Die Helligkeit, eine Kombination aus Extinktionskoeffizient und Quantenausbeute, beeinflusst, wie leicht ein FP erkannt werden kann. Photostabilität, also die Beständigkeit gegen Photobleichung, ist für Zeitrafferaufnahmen oder bei Verwendung hochintensiver Beleuchtung von entscheidender Bedeutung.
- Oligomerer Zustand
FPs können monomer, dimer oder tetramer sein. Monomere FPs werden für Fusionskonstrukte bevorzugt, da es weniger wahrscheinlich ist, dass sie die natürliche Funktion des interessierenden Proteins beeinträchtigen. Allerdings können dimere oder tetramere FPs bei Anwendungen nützlich sein, die eine höhere Helligkeit oder Oligomerisierung erfordern.
- Reifezeit
Die Reifungszeit, das Intervall zwischen der FP-Synthese und dem Einsetzen der Fluoreszenz, variiert zwischen den FPs. Schnell reifende FPs sind für die Beobachtung dynamischer Prozesse unerlässlich, während eine langsamere Reifung in statischen Studien tolerierbar sein könnte.
- Zelluläre Lokalisierung
Bestimmte FPs werden so konstruiert, dass sie sich in bestimmten Zellkompartimenten wie dem Zellkern, den Mitochondrien oder der Plasmamembran lokalisieren. Die Auswahl eines FP mit dem geeigneten Lokalisierungssignal kann eine gezielte Bildgebung erleichtern.
Beliebte fluoreszierende Proteine und ihre Anwendungen
- GFP und seine Varianten
GFP ist mit seiner Spitzenanregung bei 488 nm und seiner Emission bei 509 nm aufgrund seiner Helligkeit und Stabilität nach wie vor eine beliebte Wahl. Varianten wie Enhanced GFP (eGFP) bieten eine verbesserte Helligkeit und Expression in Säugetierzellen.
- Rot fluoreszierende Proteine (RFPs)
RFPs wie mCherry bieten Optionen für mehrfarbige Bildgebung mit GFP. mCherry regt bei 587 nm an und emittiert bei 610 nm, was eine klare Unterscheidung von GFP-Signalen ermöglicht.
- Fernrote und nahinfrarote FPs
Für die Bildgebung tiefer Gewebe sind Fernrot- und Nahinfrarot-FPs wie mPlum und iRFP von unschätzbarem Wert. Diese Proteine überlappen nur minimal mit der Autofluoreszenz und können tiefer in Gewebe eindringen.
- Photoaktivierbare und photoschaltbare FPs
Diese FPs ändern ihre Fluoreszenzeigenschaften bei Lichteinwirkung und ermöglichen so eine hochauflösende Bildgebung und Verfolgung der Proteindynamik. Photoaktivierbares GFP (PA-GFP) und Dronpa sind Beispiele für solche vielseitigen Werkzeuge.
Überlegungen für bestimmte Anwendungen
- Live-Zellbildgebung
Wählen Sie für die Bildgebung lebender Zellen FPs mit hoher Photostabilität, moderaten Reifezeiten und geeigneter Zelllokalisierung. Photoaktivierbare und photoschaltbare FPs eignen sich besonders zur Verfolgung dynamischer Prozesse.
- Mehrfarbige Bildgebung
Wählen Sie bei der Durchführung mehrfarbiger Bildgebung FPs mit unterschiedlichen und nicht überlappenden Emissionsspektren aus. Erwägen Sie den Einsatz spektraler Entmischungstechniken, um die Signaltrennung weiter zu verbessern.
- Super-Resolution-Mikroskopie
Superauflösungstechniken erfordern FPs mit hoher Helligkeit und Photostabilität. Photoaktivierbare und photoschaltbare FPs sind auch für Techniken wie PALM und STORM von Vorteil.
- FRET-basierte Anwendungen
Für Anwendungen des Förster-Resonanzenergietransfers (FRET) ist die Auswahl von Donor- und Akzeptor-FPs mit überlappenden Emissions- bzw. Anregungsspektren von entscheidender Bedeutung. GFP und seine Varianten werden häufig als Spender verwendet, während RFPs als Akzeptoren dienen.
Zukünftige Richtungen und Innovationen
Abschluss
Verweise
1. Shimomura, O., et al. (1962). „Extraktion, Reinigung und Eigenschaften von Aequorin, einem biolumineszierenden Protein aus dem leuchtenden Hydromedusan Aequorea.“ Zeitschrift für zelluläre und vergleichende Physiologie.
2. Tsien, R.Y. (1998). „Das grün fluoreszierende Protein.“ Jahresrückblick auf die Biochemie.
3. Shaner, N.C., et al. (2005). „Ein Leitfaden zur Auswahl fluoreszierender Proteine.“ Naturmethoden.
4. Patterson, G.H., et al. (2002). „Neue Fluoreszenzfarbstoffe für die Zellbiologie.“ Biotechniken.
5. Lippincott-Schwartz, J., et al. (2001). „Photobleichung und Photoaktivierung: Verfolgung der Proteindynamik in lebenden Zellen.“ Naturzellbiologie.
6. Zhang, J., et al. (2002). „Entwicklung neuer Fluoreszenzsonden für die Zellbiologie.“ Nature Reviews Molekulare Zellbiologie.
7. Chudakov, D. M., et al. (2010). „Fluoreszierende Proteine und ihre Anwendungen bei der Bildgebung lebender Zellen und Gewebe.“ Physiologische Rezensionen.
8. Giepmans, B.N.G., et al. (2006). „Die fluoreszierende Toolbox zur Beurteilung der Proteinposition und -funktion.“ Wissenschaft.
19th Jul 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024