Apoptose (intrinsische und extrinsische Wege)
Bei Assay Genie haben wir einen umfassenden Leitfaden erstellt, der alles enthält, was Sie über Apoptose wissen müssen!
Wichtige Erkenntnisse:
1. Apoptose ist ein programmierter Zelltodprozess, der für die Gewebeerhaltung und Krankheitsprävention von entscheidender Bedeutung ist.
2. Im Gegensatz zur Nekrose umfasst die Apoptose Zellschrumpfung, Zellkernzerfall, Membranzerstörung und Fragmentierung in apoptotische Körper.
3. Der p53-Weg, intrinsische und extrinsische Wege sowie Caspase-Kaskaden sind Schlüsselmechanismen bei der Apoptose.
4. Apoptose vs. Nekrose: Apoptose ist kontrolliert und natürlich, während Nekrose unkontrolliert und schädlich ist.
5. p53-Weg: Wird durch DNA-Schäden aktiviert und umfasst Proteine wie Bax, Bak, Bad.
6. Intrinsische Apoptose: Wird intern durch zellulären Stress ausgelöst; extrinsisch durch externe Signale.
7. Caspasen: Entscheidende Enzyme für die Apoptoseausführung, gruppiert nach Funktion.
Was ist Apoptose?
Apoptose ist eine Art Zelltod, der auftritt, wenn das apoptotische Programm der Zelle aktiviert wird. Bei diesem Programm handelt es sich um eine Reihe von Anweisungen, die in der DNA der Zelle kodiert sind. Wenn die Apoptose ausgelöst wird, durchläuft die Zelle eine Reihe von Veränderungen, die letztendlich zu ihrem Tod führen.
Veränderungen bei der Apoptose:
• Die Zelle schrumpft und wird runder
• Der Zellkern zerfällt in Fragmente
• Die Plasmamembran der Zelle bricht zusammen
• Die Zelle zerfällt in kleinere Stücke (apoptotische Körper)

Sobald die Apoptose im Gange ist, ist sie irreversibel und die Zelle kann nicht gerettet werden. Apoptose ist ein normaler Prozess, der ständig in unserem Körper abläuft. Es ist beispielsweise dafür verantwortlich, alte, beschädigte oder nicht mehr benötigte Zellen loszuwerden. Apoptose ist auch ein wichtiger Akteur bei Entwicklung und Immunität.
Apoptose vs. Nekrose
Der Hauptunterschied zwischen Apoptose und Nekrose besteht darin, dass Apoptose ein natürlicher und kontrollierter Prozess des Zelltods ist, während Nekrose ein unkontrollierter Prozess des Zelltods ist. Apoptose ist wichtig für die Entwicklung und Erhaltung von gesundem Gewebe, während Nekrose zu Gewebeschäden führt.
Apoptose ist eine Art programmierter Zelltod, der als Reaktion auf verschiedene Reize wie DNA-Schäden oder Virusinfektionen auftritt. Apoptose ist durch mehrere morphologische Veränderungen gekennzeichnet, darunter Zellschrumpfung, Ausbeulung der Plasmamembran (bekannt als Bläschenbildung), Chromatinkondensation und Bildung apoptotischer Körper.
Nekrose hingegen ist eine Art Zelltod, der als Reaktion auf extremen Stress auftritt, beispielsweise durch die Einwirkung von Toxinen oder Infektionen. Nekrose ist durch Zellschwellung, Membranriss und Freisetzung von Entzündungsmediatoren gekennzeichnet.

Verwandte Ressourcen
p53 Apoptoseweg
Als eines der wichtigsten Tumorsuppressorproteine ist p53 in Krebszellen häufig mutiert oder verloren. Dies kann zu unkontrolliertem Zellwachstum und schließlich zur Tumorbildung führen. p53 spielt auch eine Schlüsselrolle bei der Apoptose, dem programmierten Zelltod. Wenn die DNA beschädigt ist, wird p53 aktiviert und löst Apoptose aus, um die Teilung und Ausbreitung der beschädigten Zellen zu verhindern.
An der p53-vermittelten Apoptose sind mehrere Signalproteine beteiligt, darunter Bax, Bak und Bad. Bax und Bak sind pro-apoptotische Proteine, die den Zelltod fördern, während Bad ein anti-apoptotisches Protein ist, das den Zelltod hemmt. Wenn eine DNA-Schädigung auftritt und p53 aktiviert wird, werden Bax und Bak in die Mitochondrien rekrutiert, wo sie die Freisetzung von Cytochrom c bewirken. Cytochrom C löst eine Kaskade von Ereignissen aus, die zum Zelltod führen. Bad wird außerdem durch p53 phosphoryliert, was verhindert, dass es den Zelltod hemmt.
Zusammenfassend spielt p53 eine entscheidende Rolle bei der Vermittlung der Apoptose als Reaktion auf DNA-Schäden. Der p53-Apoptoseweg umfasst mehrere wichtige Signalproteine, darunter Bax, Bak und Bad. Wenn eine DNA-Schädigung auftritt, aktiviert p53 diese Proteine, um den Zelltod auszulösen und die Ausbreitung der beschädigten Zellen zu verhindern.
Apoptose-bezogene Tests
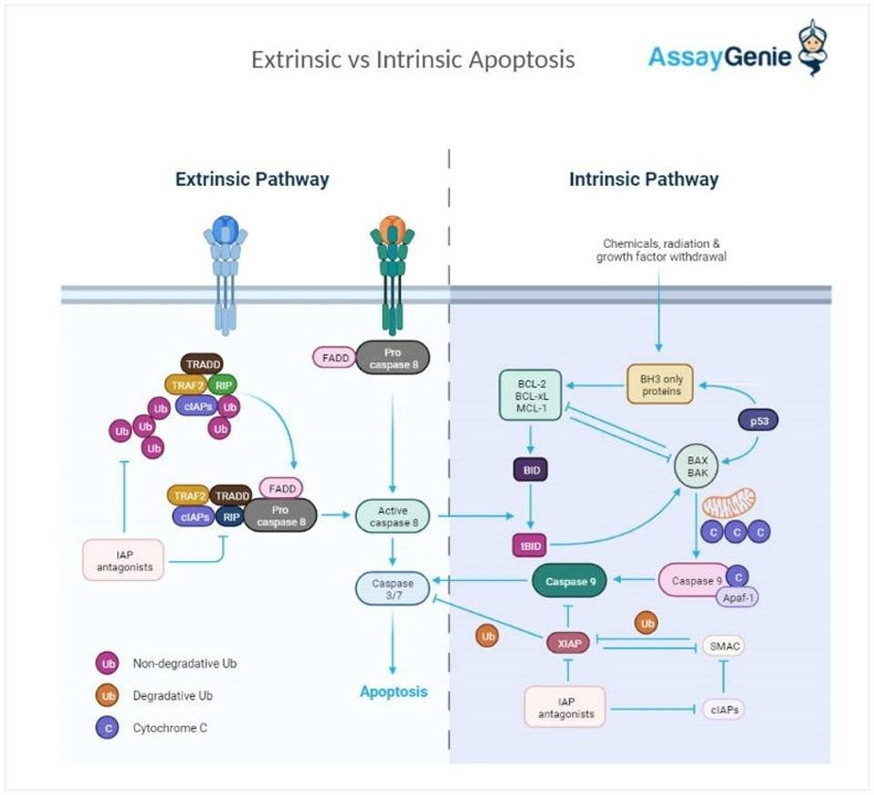
Intrinsische vs. extrinsische Apoptose
Intrinsische Apoptose ist ein Prozess, der aus dem Inneren der Zelle heraus initiiert wird, oft als Reaktion auf zelluläre Stressfaktoren wie DNA-Schäden. Die extrinsische Apoptose hingegen wird durch externe Signale anderer Zellen ausgelöst. Apoptose ist ein Schlüsselmechanismus zur Aufrechterhaltung der Zellhomöostase und zur Verhinderung der Entstehung von Krankheiten wie Krebs.

Der extrinsische Apoptose-Weg
Der extrinsische Weg der Apoptose wird entweder durch ein extrazelluläres Signal ausgelöst, das einen Todesrezeptor (z. B. Fas, TNF) aktiviert, oder durch die Freisetzung von Granzym B und Perforin aus zytotoxischen Lymphozyten als Teil der angeborenen Immunantwort auf eine Infektion (Goping et al. , 2003). Die Aktivierung der Todesrezeptoren führt zu deren Oligomerisierung und Rekrutierung der zytosolischen Adapterproteine (z. B. FADD, TRADD), was den Aufbau des Todes-induzierenden Signalkomplexes (DISC) erleichtert, der aus den Todesrezeptoren und zugehörigen Adapterproteinen zusammen besteht mit Procaspase-8 (Ashkenazi et al., 1998).
Zelltodrezeptoren bei extrinsischer Apoptose
Der extrinsische Weg der Apoptose wird durch Todesrezeptoren (DRs) vermittelt, die zur Superfamilie der Tumornekrosefaktor (TNF)-Rezeptoren gehören. Zu den Mitgliedern dieser Familie gehören TNFR1, CD95/Fas, TRAIL-R1/DR4 und TRAIL-R2/DR5 (Itoh et al., 1991; Pan et al., 1997; Tartaglia et al., 1993). Diese Rezeptoren werden üblicherweise auf der Oberfläche von Zellen als homotrimere Transmembranproteine vom Typ I exprimiert und sind durch das Vorhandensein von Cystein-reichen extrazellulären Domänen gekennzeichnet (Ashkenazi und Dixit, 1998). Todesrezeptoren enthalten außerdem eine zytoplasmatische Domäne von etwa 80 Aminosäuren, die als Todesdomäne (DD) bezeichnet wird und eine wichtige Rolle bei der Übertragung des Todessignals von der Zelloberfläche an intrazelluläre Signalwege spielt.
Caspase-8-vermittelte Apoptose
Bei Aktivierung kann Caspase-8 das apoptotische Signal durch Spaltung weiterer stromabwärts gelegener Effektor-Caspasen wie Caspase-3 verbreiten (Medema et al., 1997; Murphy et al., 2004). Es wurde jedoch auch berichtet, dass Caspase-8 auf ähnliche Weise wie Caspase-9 aktiviert werden kann, wenn keine Verarbeitung erforderlich ist und Caspase-8 durch Dimerisierung aktiviert wird (Boatright et al., 2003; Donepudi und Grutter, 2002).
Unter bestimmten Bedingungen können Caspasen-8 stromabwärts gelegene Caspasen nicht direkt aktivieren und daher wurden zwei Zelltypen beschrieben, die beide den CD95-Rezeptor/Ligand-Komplex nutzen (Scaffidi et al., 1998). In sogenannten Typ-I-Zellen wird der Tod durch große Mengen aktiver Caspase-8 ausgelöst, die am DISC produziert werden, was zur direkten Spaltung von Caspase-3 vor dem Verlust des mitochondrialen Transmembranpotentials führt. Im Vergleich dazu reicht bei Typ-II-Zellen die Aktivierung des Todesrezeptorwegs allein nicht aus, um Apoptose auszulösen. In diesen Zellen wird wenig DISC gebildet und daher steht eine geringere Menge an aktiver Caspase-8 zur Verfügung. Daher muss das apoptotische Signal durch gleichzeitige Aktivierung des mitochondrialen Signalwegs verstärkt werden.
Dieser Weg wird durch Caspase-8-vermittelte Spaltung eines BH3-Domänen enthaltenden Bcl-2-Familienmitglieds Bid durchgeführt. Aktive Caspase-8 spaltet Bid, um eine verkürzte Form (tBid) zu erzeugen, die entweder allein oder in Kombination mit anderen Molekülen die Mitochondrien dazu veranlasst, proapoptotische Faktoren wie Cytochrom C freizusetzen, was zur Bildung des Apoptosomenkomplexes führt (Li et al., 1998; Luo et al., 1998).
Der intrinsische Apoptose-Weg
Was ist MOMP?
MOMP steht für Mitochondriale Außenmembranpermeabilisierung. Der Prozess der Apoptose wird durch die Regulierung von MOMP durch pro-apoptotische und anti-apoptotische Mitglieder der Bcl-2-Proteinfamilie vermittelt (Green et al., 2004). MOMP ist der Punkt, an dem es kein Zurück mehr gibt, an dem Zellen irreversibel dem Zelltod unterliegen (Tait et al., 2010) und die Freisetzung apoptogener Proteine wie Cytochrom C, EndoG, Smac/DIABLO, AIF-1 und Omi/HtrA2 verursacht den Intermembranraum in das Zytoplasma.
Die Freisetzung von Cytochrom C in das Zytoplasmakompartiment führt zu seiner Wechselwirkung mit Apaf-1, was die Spaltung von Procaspase-9, die Bildung des Apaf-1/Caspase-9-Apoptosomenkomplexes und die anschließende Aktivierung von Effektorcaspasen ermöglicht (Li et al. , 1997; Zou et al., 1999). Es wird angenommen, dass das Schicksal der Zelle letztlich durch die relative Häufigkeit und Aktivität der gegenüberliegenden Bcl-2-Proteine bestimmt wird.
Proteine der Bcl-2-Familie und Zelltodregulation
Proteine der Bcl-2-Familie sind Schlüsselregulatoren der Apoptose. Alle Familienmitglieder teilen Homologie mit dem archetypischen Familienmitglied, dem B-Zell-Lymphom-2-Protein (Bcl-2), das vier Bcl-2-Homologiedomänen enthält, die als BH 1–4 klassifiziert sind. Proteine der Bcl-2-Familie können funktionell in pro-apoptotische und anti-apoptotische Mitglieder unterteilt werden. Proapoptotische Bcl-2-Proteine können basierend auf Struktur und Funktion weiter in zwei Gruppen unterteilt werden, entweder als reine BH3- oder als Multidomänen-Mitglieder.
Bax & Bak – MOMP-regulierende Proteine
Bax und Bak funktionieren, indem sie homo- oder heterodimere Poren in der äußeren Mitochondrienmembran (MOMP) bilden und die Freisetzung apoptogener Faktoren in das Zytosol katalysieren. Jüngste Berichte deuten darauf hin, dass Bid, Bim und PUMA die Hauptaktivatoren der Bax/Bak-Dimerisierung sind, während die anderen reinen BH3-Proteine unterstützend wirken (Kim et al., 2006). Anti-apoptotische Bcl-2-Mitglieder besitzen alle die BH-Domänen 1–4 und alle außer Bcl-2A1 haben eine Transmembranregion. Anti-apoptotische Mitglieder verhindern die Bildung von Bax/Bak-Dimeren. Die Hauptfunktion von pro-apoptotischen Bcl-2-Proteinen besteht daher darin, stabile Heterodimere mit den anti-apoptotischen Mitgliedern der Familie zu bilden und diese somit zu binden, was eine Bax/Bak-Dimerisierung und anschließende MOMP-Bildung ermöglicht.
Es wurden zwei gegensätzliche Mechanismen für die MOMP-Bildung vorgeschlagen. Im indirekten Modell wirken alle pro-apoptotischen Nur-BH3-Proteine nur durch Interaktion mit anti-apoptotischen Mitgliedern (Willis et al., 2005; Willis et al., 2007). Im direkten Modell werden reine BH3-Proteine weiter unterteilt in Sensibilisatoren (Bad, Bmf, Noxa), die die anti-apoptotischen Mitglieder antagonisieren, und Aktivatoren (Bim, Puma, tBid), die die Bak/Bax-Dimerisierung direkt fördern (Galonek et al. , 2006; Hyungjin et al., 2006).
Nur BH3-Proteine
Puma- und Noxa-Expression und Zelltodaktivierung
Puma und Noxa wurden durch Genexpressionsprofile für Ziele des Tumorsuppressors p53 und durch Hefe-Zwei-Hybrid-Screenings unter Verwendung von Bcl-2 als Köder identifiziert [Han et al., 2001; Nakano und Vousden, 2001; Oda et al., 2000; Yu et al., 2001]. Der Transkriptionsfaktor p53 reguliert die Transkription von Puma und Noxa nach einer DNA-Schädigung hoch und löst so Apoptose aus [Villunger et al., 2003a].
Puma und Noxa können die Mitglieder der antiapoptotischen Bcl-2-Familie, Mcl-1, Bcl-2 und Bcl-XL, binden und hemmen, was zur Apoptose führt [Nakano und Vousden, 2001; Oda et al., 2000; Yu et al., 2001]. Kürzlich wurde Noxa durch erhöhte Expression und die Verdrängung von Mcl-1 aus dem Autophagie-Regulator Beclin-1 mit dem H-Ras-vermittelten autophagischen Zelltod in Verbindung gebracht [Elgendy et al., 2010].
Schlecht vermittelter Zelltod
Das reine BH3-Protein Bad wurde ursprünglich durch Hefe-Zwei-Hybrid- und -Phagen-Bibliotheksscreenings als Bcl-XL-Interaktor identifiziert und es wurde festgestellt, dass es selektiv mit Bcl-2 und Bcl-XL dimerisiert, nicht jedoch mit Mcl-1 [Yang et al., 1995]. In Gegenwart des Überlebensfaktors IL-3 wird Bad durch die Ser/Thr-Kinase Akt phosphoryliert, was zu seiner Bindung an die 14-3-3-Proteine führt und so seine apoptotische Funktion hemmt [Datta et al., 1997; Zha et al., 1996]. Die Phosphorylierung von Bad durch Cdk1 in postmitotischen Neuronen führt zur Dissoziation von Bad von 14-3-3-Proteinen und anschließendem Zelltod [Konishi et al., 2002].
Bim-Phosphorylierung und antiapoptotische Wirkungen
Das reine BH3-Protein Bim wurde ausführlich als Mediator intrinsischer Zelltodwege charakterisiert. Nach zellulärem Stress wie UV-Bestrahlung, Taxol-Behandlung und Entzug des Serum-Wachstumsfaktors lokalisiert sich Bim in den Mitochondrien und hemmt die antiapoptotischen Mitglieder der Bcl-2-Familie, Bcl-2, Bcl-XL und Mcl-1, und aktiviert Bak und Bax führte zu MOMP und anschließendem Zelltod [Kutuk und Letai, 2010].
Es wurde gezeigt, dass ERK1/2 BimEL an mehreren Stellen phosphoryliert [Weston et al., 2003]. Die Phosphorylierung von BimEL durch ERK1/2 nach Serumentzug führt zu dessen Abbau durch 20S-Proteasomen [Wiggins et al., 2011]. BimEL wird von ERK1/2 an bis zu sechs verschiedenen Resten phosphoryliert, von denen sich drei innerhalb von Exon 3 befinden, einem Exon, das nur in BimEL exprimiert wird. Die Phosphorylierung von BimEL durch ERK1/2 erfordert die DEF-Domäne (Andockstelle für ERK, FXFP) innerhalb von Exon 3.
PD-1 und Apotose
Das programmierte Zelltodprotein 1 (PD-1) befindet sich auf der Oberfläche von T-Zellen und spielt eine wesentliche Rolle bei der Regulierung von Immunantworten, indem es die T-Zell-Aktivierung verringert. Durch die Bindung an PD-L1 oder PD-L2 löst es Apoptose innerhalb der Ziel-T-Zellen aus – ein Phänomen, das als programmierter Zelltod bekannt ist.
PD-1-vermittelte Apoptose ist ein Prozess, durch den das körpereigene Immunsystem potenziell gefährliche aktivierte T-Zellen loswerden kann. Wenn T-Zellen einem Antigen ausgesetzt werden, schalten sie ihre PD-1-Expression ein und interagieren entweder mit PD-L1 oder PD-L2, die in Antigen-präsentierenden Zellen (APC) oder anderen Zelltypen im Organismus vorhanden sind. Diese daraus resultierende Interaktion löst den programmierten Tod von T-Zellen aus und verhindert so das Auftreten ungerechtfertigter systemischer Entzündungsreaktionen.
Krebszellen nutzen den PD-1/PD-L1-Signalweg, um der Erkennung durch Immunantworten zu entgehen und diese zu behindern, sodass Tumore ungehindert wachsen können. Indem bösartige Zellen einen hohen PD-L1-Spiegel aufweisen, können sie die T-Zell-Aktivität hemmen und sie davon abhalten, den Tumor anzugreifen. Um dieser Taktik entgegenzuwirken, haben Wissenschaftler Immuntherapeutika erfunden, die auf beide Proteine abzielen – und ihre Ergebnisse gegen eine Vielzahl von Krebsarten waren bisher unglaublich vielversprechend!
Dennoch kann die Blockierung der PD-1/PD-L1-Signalübertragung zu ungünstigen Immunreaktionen wie Autoimmunerkrankungen und Gewebeschäden führen. Daher ist es wichtig, die Vorteile und Risiken einer PD-1/PD-L1-Blockade bei der Behandlung von Krebspatienten richtig abzuwägen.
Zusammenfassend lässt sich sagen, dass PD-1 ein wesentlicher Bestandteil der Regulierung der T-Zell-Apoptose und des Immunsystems ist. Die Wechselwirkungen zwischen PD-1, PD-L1 und PD-L2 können große Auswirkungen auf die Behandlung von Krebs und Autoimmunerkrankungen haben. Weitere Forschungen sollten durchgeführt werden, um das Verständnis darüber zu erweitern, wie genau PD-1 Apoptose induziert, um effiziente Therapien zu entwickeln, die auf diesen Weg abzielen, ohne Schäden oder Nebenwirkungen zu verursachen.
Caspase-Apoptose-Weg
Caspasen können auf der Grundlage ihrer Substratspezifität oder der Länge ihrer Prodomäne in drei verschiedene Gruppen eingeteilt werden (Grutter, 2000; Thornberry und Lazebnik, 1998). Caspasen der Gruppe I fungieren hauptsächlich als Entzündungs mediatoren und umfassen die Caspasen -1, -4, -5, -11 und -14. Sie sind an der Aktivierung und Verarbeitung entzündungsfördernder Zytokine beteiligt und scheinen bei der Apoptose keine Hauptrolle zu spielen. Die Caspasen der Gruppe I bevorzugen sperrige hydrophobe Reste in der P4-Position, wie Tyrosin oder Tryptophan. (Nicholson, 1999; Thornberry et al., 1997).
Caspase 3/7 Zelltod-Signalisierung
Caspase 3 und 7 sind zwei wichtige apoptotische Enzyme, die zusammenarbeiten, um den Zelltod einzuleiten. Caspase 3 ist für die Spaltung von Proteinen verantwortlich, die zum Zelltod führen, während Caspase 7 Caspase 3 aktiviert. Beide Enzyme werden durch proapoptotische Signale aktiviert, die durch eine Vielzahl von Reizen, einschließlich DNA-Schäden, oxidativem Stress usw., ausgelöst werden können apoptotische Hormone. Nach der Aktivierung arbeiten Caspase 3 und 7 zusammen, um eine Vielzahl zellulärer Proteine zu spalten, was letztendlich zum Zelltod führt.
Die durch Caspase 3/7 vermittelte Apoptose ist ein entscheidender Prozess, der dazu beiträgt, die Gewebehomöostase aufrechtzuerhalten und die Entstehung von Krebs zu verhindern. Apoptose ist eine Art programmierter Zelltod, der als Reaktion auf verschiedene Reize auftritt, darunter DNA-Schäden, oxidativen Stress und apoptotische Hormone. Caspase 3 und 7 sind zwei Schlüsselenzyme, die zusammenarbeiten, um die Apoptose auszulösen. Caspase 3 spaltet Proteine, die zum Zelltod führen, während Caspase 7 Caspase 3 aktiviert.
Apoptose ist ein entscheidender Prozess, der dazu beiträgt, die Gewebehomöostase aufrechtzuerhalten und die Entstehung von Krebs zu verhindern. Caspase-vermittelte Apoptose ist eine Art des programmierten Zelltods, der als Reaktion auf verschiedene Reize auftritt, darunter DNA-Schäden, oxidativen Stress und apoptotische Hormone.
Caspase 8-Aktivierung, Spaltstelle und Weg
Caspase 8 ist ein wichtiger Regulator der Apoptose und seine Aktivierung ist für die Einleitung des Zelltods unerlässlich. Wenn Apoptose ausgelöst wird, spaltet Caspase 8 und aktiviert nachgeschaltete Proteine, die zum Zelltod führen. Die Caspase-8-Spaltungsstelle befindet sich an der Aminosäure Asp315, die sich innerhalb des DEVD-Motivs befindet.
Diese Spaltstelle ist essentiell für die Aktivierung von Caspase 8 und die anschließende Apoptose. Die Caspase-8-Signalisierung führt zur Aktivierung mehrerer nachgeschalteter apoptotischer Proteine, einschließlich der Caspasen 3, 6 und 7. Diese Proteine führen dann den Zelltod aus, indem sie DNA-Fragmentierung und Zellschrumpfung verursachen.
Caspase 9-Aktivierung, Spaltstelle und Weg
Caspase 9 ist eine wichtige Initiator-Caspase im apoptotischen Weg. Es wird durch proteolytische Spaltung an bestimmten Stellen aktiviert, was zur Freisetzung seiner aktiven katalytischen Domäne führt. Dies führt dann zur Bildung eines Apoptosoms, einem Schlüsselkomplex bei der Auslösung der Apoptose.
Caspase 9 wird durch proteolytische Spaltung an Asp-315 und Asp-330 aktiviert, die sich in der Linkerregion zwischen der großen und kleinen Untereinheit befinden. Dies führt zur Freisetzung der aktiven katalytischen Domäne, die dann ein Apoptosom bildet. Das Apoptosom ist ein Schlüsselkomplex bei der Auslösung der Apoptose und besteht aus Caspase 9, Caspase 3 und proapoptotischen Proteinen wie Cytochrom C.
Wenn Caspase 9 an Asp-315 gespalten wird, kommt es zur Bildung eines aktiven Tetramers, das in der Lage ist, an Caspase 3 zu binden und diese zu spalten. Dies führt zur Aktivierung von Caspase 3, was dann zur proteolytischen Spaltung einer Reihe von Caspase 3 führt Schlüsselproteine, die am Zelltod beteiligt sind.
IAPS-Regulation der Apoptose
Die IAPs regulieren die Apoptose durch direkte Caspase-Hemmung (Deveraux und Reed, 1999; Deveraux et al., 1998; Riedl et al., 2001; Shiozaki et al., 2003). Interessanterweise scheinen IAPs multifunktional zu sein und sind nicht nur an der Regulierung der Apoptose beteiligt, sondern auch an der rezeptorvermittelten Signalübertragung, dem Zellzyklus und der Ubiquitylierung (Birkey Reffey et al., 2001; Hofer-Warbinek et al., 2000; Huang et al., 2000; Lu et al., 2002; Sanna et al., 2007;
15th Aug 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024