Alzheimer-Krankheit: Ein umfassender Einblick
Die Alzheimer-Krankheit stellt eine gewaltige Herausforderung im Bereich der neurologischen Störungen dar, die durch ihren fortschreitenden Charakter und ihre tiefgreifenden Auswirkungen auf die kognitiven Funktionen gekennzeichnet ist. Dieser Artikel befasst sich eingehender mit den Facetten der Alzheimer-Krankheit und untersucht ihre Ursachen, Mechanismen, klinischen Manifestationen und aktuellen Therapiestrategien, angereichert mit aktuellen wissenschaftlichen Erkenntnissen.
Ätiologie und Risikofaktoren
Genetische Faktoren
Die genetische Landschaft der Alzheimer-Krankheit ist komplex und weist sowohl erbliche (familiäre AD) als auch sporadische Formen auf. Zu den Schlüsselgenen, die an der Pathogenese beteiligt sind, gehören das Amyloid-Vorläuferprotein (APP), Presenilin-1 (PSEN1) und Presenilin-2 (PSEN2). Mutationen in diesen Genen führen zu einer veränderten Verarbeitung von APP, was das Risiko, an einer frühen Alzheimer-Krankheit zu erkranken, deutlich erhöht.
Umwelt- und Lebensstilfaktoren
Über die Genetik hinaus spielen Umwelt- und Lebensstilfaktoren eine entscheidende Rolle beim Ausbruch und Fortschreiten der Krankheit. Dazu gehören kardiovaskuläre Risikofaktoren (Bluthochdruck, Diabetes und Hypercholesterinämie), Kopftrauma und die Exposition gegenüber bestimmten Umweltgiften. Lebensstilentscheidungen wie Ernährung, Bewegung und kognitives Engagement werden mit dem Alzheimer-Risiko in Verbindung gebracht, was darauf hindeutet, dass veränderbare Faktoren die Krankheitsentwicklung beeinflussen könnten.
Unterschiede zwischen einem Alzheimer-Gehirn und einem normalen Gehirn
Besonderheit | Alzheimer-Gehirn | Normales Gehirn |
Schrumpfung des Gehirns | Signifikante Atrophie, insbesondere im Hippocampus und in der Hirnrinde | Minimale Schrumpfung im Zusammenhang mit normaler Alterung |
Amyloid-Plaques | Hohe Akkumulation von Amyloid-beta-Protein | Fehlende oder minimale Mengen, die mit normalem Altern verbunden sind |
Neurofibrilläre Verwicklungen | Hohe Akkumulation von Tau-Protein | Fehlende oder minimale Mengen, die mit normalem Altern verbunden sind |
Synaptischer Verlust | Signifikante Reduzierung der synaptischen Verbindungen | Relativ stabile synaptische Verbindungen |
Neurotransmitter-Defizite | Deutliche Abnahme der wichtigsten Neurotransmitter (z. B. Acetylcholin) | Höhere Spiegel von Neurotransmittern, die die kognitiven Funktionen unterstützen |
Entzündungsreaktion | Chronische Entzündung mit aktivierten Mikroglia und Astrozyten | Akute Entzündungsreaktionen, die nach der Beseitigung von Erregern oder Schäden abklingen |
Oxidativer Stress | Erhöht, was zu neuronalen Schäden führt | Präsentieren in deutlich geringerem Maße effiziente Gegenmechanismen |
Biomarker | Nachweisbar über PET-Scans und Liquoranalyse | Nicht vorhanden oder nicht in signifikanten Mengen nachweisbar |

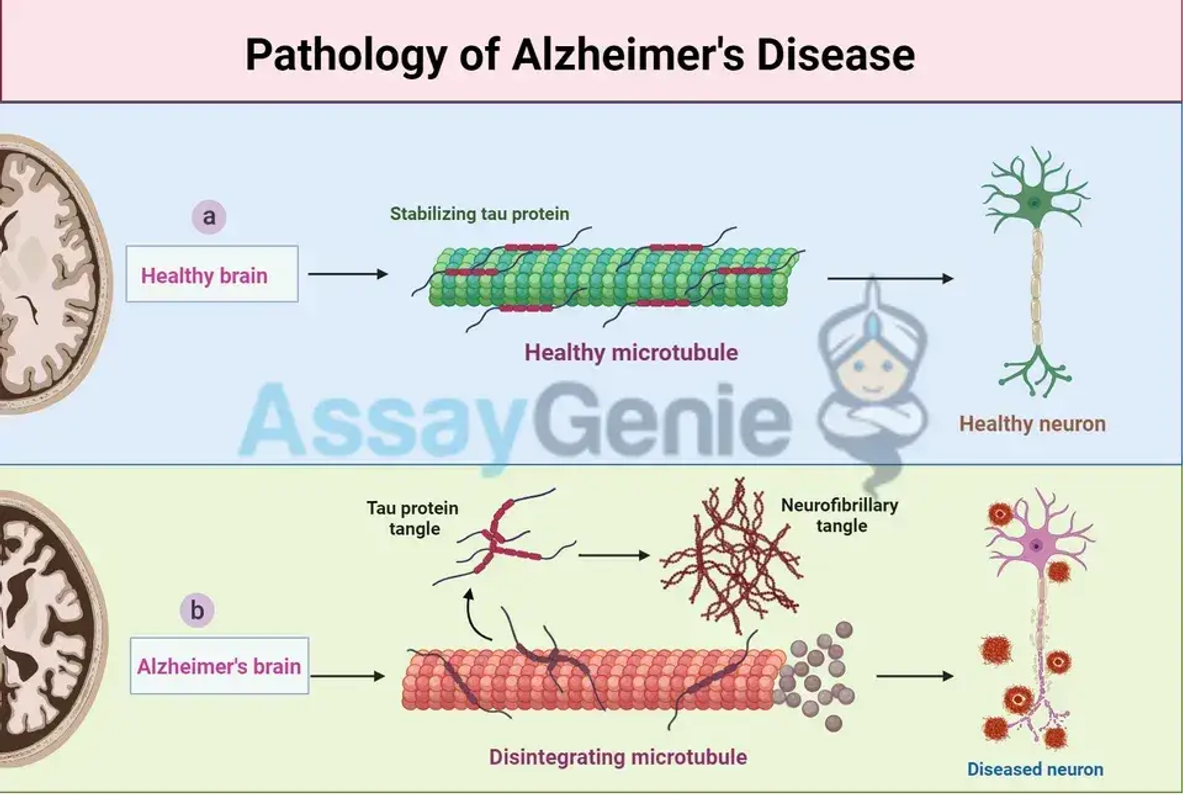
Pathogenese
Amyloid-Hypothese
Die Amyloid-Hypothese geht davon aus, dass die Ansammlung von Amyloid-beta (Aβ)-Peptiden im Gehirn das erste Ereignis in der Pathogenese der Alzheimer-Krankheit ist. Diese Peptide aggregieren zu Plaques, stören die neuronale Funktion und lösen eine Kaskade neurodegenerativer Prozesse aus.
Tau-Hypothese
Tau, ein Mikrotubuli-assoziiertes Protein, wird bei der Alzheimer-Krankheit hyperphosphoryliert, was zur Bildung neurofibrillärer Knäuel innerhalb von Neuronen führt. Dies stört das neuronale Transportsystem und trägt zum Zelltod und kognitiven Verfall bei.
Neuroinflammation
Chronische Neuroinflammation ist ein Kennzeichen der Alzheimer-Krankheit und zeichnet sich durch die Aktivierung von Mikroglia und Astrozyten aus. Diese Gliazellen sind zwar zunächst schützend, setzen jedoch entzündungsfördernde Zytokine frei, die mit der Zeit neuronale Schäden verschlimmern.

Klinische Manifestationen
Frühe Symptome
Die ersten Symptome der Alzheimer-Krankheit sind oft subtil und beginnen typischerweise mit einem Verlust des Kurzzeitgedächtnisses. Mit fortschreitender Krankheit kann es bei den Patienten zu Schwierigkeiten bei der Sprache, den räumlichen Fähigkeiten und den exekutiven Funktionen kommen.
Verhaltens- und psychologische Symptome
Verhaltensänderungen wie Unruhe, Apathie und Depression wirken sich erheblich auf die Lebensqualität der Patienten und ihrer Betreuer aus. Diese Symptome stellen eine Herausforderung bei der Behandlung und Pflege dar und verdeutlichen die Notwendigkeit umfassender Therapieansätze.
Therapeutische Ansätze
Pharmakologische Behandlungen
Aktuelle pharmakologische Behandlungen zielen eher auf die Linderung der Symptome als auf die Heilung der Krankheit ab. Cholinesterasehemmer und NMDA-Rezeptorantagonisten werden verschrieben, um die kognitiven Symptome bei leichter bis mittelschwerer Alzheimer-Krankheit zu verbessern.
Neue Therapien
Derzeit wird an der Entwicklung krankheitsmodifizierender Medikamente geforscht, die auf die Amyloid- und Tau-Signalwege abzielen. Immuntherapien wie monoklonale Antikörper gegen Amyloid-Beta gehören zu den vielversprechendsten Ansätzen, die derzeit untersucht werden.
Nicht-pharmakologische Interventionen
Um das Auftreten oder Fortschreiten der Symptome zu verzögern, werden Änderungen des Lebensstils, einschließlich körperlicher Bewegung, kognitivem Training und Ernährungsumstellungen, empfohlen. Soziales Engagement und Unterstützung sind entscheidend für die Verbesserung des allgemeinen Wohlbefindens der Patienten.
Abschluss
Die Alzheimer-Krankheit bleibt eine komplexe und herausfordernde Erkrankung mit erheblichen Auswirkungen auf Patienten, Familien und Gesundheitssysteme. Während aktuelle Behandlungen eine Linderung der Symptome bewirken, geht die Suche nach einer Heilung weiter. Die laufende Erforschung der Pathophysiologie der Krankheit und potenzieller therapeutischer Ziele lässt auf wirksamere Interventionen in der Zukunft hoffen. Das Verständnis der vielschichtigen Natur der Alzheimer-Krankheit ist für die Entwicklung umfassender Pflegestrategien und letztlich für Durchbrüche in der Behandlung und Prävention von entscheidender Bedeutung.
Verweise
1. Alzheimer-Vereinigung. (2023). „Fakten und Zahlen zur Alzheimer-Krankheit 2023.“ Alzheimer und Demenz.
2. Hardy, J. & Selkoe, D. J. (2002). „Die Amyloid-Hypothese der Alzheimer-Krankheit: Fortschritte und Probleme auf dem Weg zur Therapie.“ Wissenschaft, 297(5580), 353-356.
3. Jack, C. R. Jr., Bennett, D. A., Blennow, K., Carrillo, M. C., Feldman, H. H., Frisoni, G. B., Hampel, H., Jagust, W. J., Johnson, K. A., Knopman, D. S., Petersen, R. C., Scheltens, P., Sperling, R. A. & Dubois, B. (2016). „NIA-AA Research Framework: Auf dem Weg zu einer biologischen Definition der Alzheimer-Krankheit.“ Alzheimer & Demenz, 14(4), 535-562.
4. Sperling, R. A., Aisen, P. S., Beckett, L. A., Bennett, D. A., Craft, S., Fagan, A. M., Iwatsubo, T., Jack, C. R. Jr., Kaye, J., Montine, T. J., Park, D. C. , Reiman, E. M., Rowe, C. C., Siemers, E., Stern, Y., Yaffe, K., Carrillo, M. C., Thies, B., Morrison-Bogorad, M., Wagster, M. V. & Phelps, C. H. (2011 ). „Auf dem Weg zur Definition der präklinischen Stadien der Alzheimer-Krankheit: Empfehlungen der Arbeitsgruppen des National Institute on Aging-Alzheimer’s Association zu Diagnoserichtlinien für die Alzheimer-Krankheit.“ Alzheimer & Demenz, 7(3), 280-292.
5. Bateman, R. J., Xiong, C., Benzinger, T. L. S., Fagan, A. M., Goate, A., Fox, N. C., Marcus, D. S., Cairns, N. J., Xie, X., Blazey, T. M., Holtzman, D. M., Santacruz , A., Buckles, V., Oliver, A., Moulder, K., Aisen, P. S., Ghetti, B., Klunk, W. E., McDade, E., Martins, R. N., Masters, C. L., Mayeux, R., Ringman, J. M., Rossor, M. N., Schofield, P. R., Sperling, R. A., Salloway, S. & Morris, J. C. (2012). „Klinische und Biomarker-Veränderungen bei dominant vererbter Alzheimer-Krankheit.“ Das New England Journal of Medicine, 367(9), 795-804.
6. De Strooper, B. & Karran, E. (2016). „Die zelluläre Phase der Alzheimer-Krankheit.“ Zelle, 164(4), 603-615.
7. Long, J. M. & Holtzman, D. M. (2019). „Alzheimer-Krankheit: Ein Update zur Pathobiologie und Behandlungsstrategien.“ Zelle, 179(2), 312-339.
8. Livingston, G., Huntley, J., Sommerlad, A., Ames, D., Ballard, C., Banerjee, S., Brayne, C., Burns, A., Cohen-Mansfield, J., Cooper , C., Costafreda, S. G., Dias, A., Fox, N., Gitlin, L. N., Howard, R., Kales, H. C., Kivimäki, M., Larson, E. B., Ogunniyi, A., Orgeta, V., Ritchie, K., Rockwood, K., Sampson, E. L., Samus, Q., Schneider, L. S., Selbæk, G., Teri, L. & Mukadam, N. (2020). „Demenzprävention, Intervention und Pflege: Bericht 2020 der Lancet Commission.“ The Lancet, 396(10248), 413-446.
1st Aug 2024
Recent Posts
-
Neuroimmunologie: Das Immunsystem des ZNS
…30th Sep 2024 -
Interleukin-8-Signalisierung
IL-8-ÜbersichtInterleukin-8 (IL-8), auch bekannt als CXCL8, wurde vor über 30 Jahren a …25th Sep 2024 -
Waardenburg-Syndrom und Klein-Waardenburg-Syndrom
Waardenburg-Syndrom: Eine seltene genetische Störung, die Pigmentierung, Hörvermögen u …25th Sep 2024